1. Introduction
La dégénérescence maculaire liée à l’âge (DMLA) touche environ 20 millions de personnes aux États-Unis et 196 millions dans le monde. La DMLA est l’une des principales causes de déficience visuelle grave chez les personnes âgées, et l’on estime à 288 millions le nombre de personnes touchées dans le monde d’ici 2040 [1].
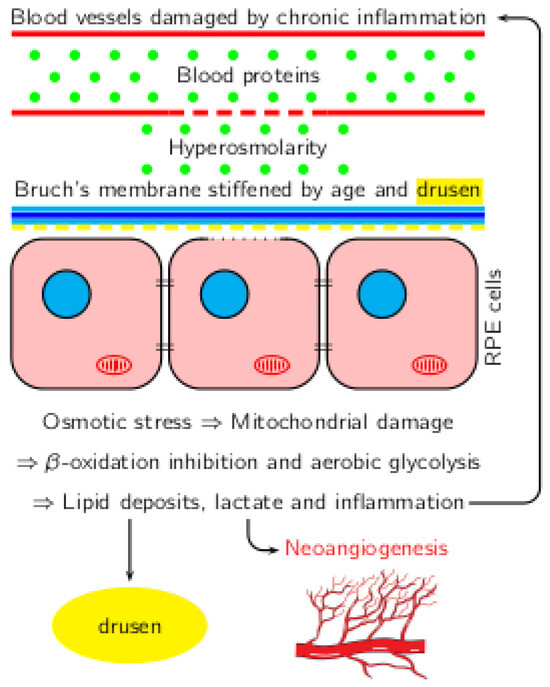
La DMLA est une maladie mal comprise qui touche principalement les personnes âgées et entraîne une perte de vision. En général, ce n’est pas la rétine périphérique qui est touchée mais la macula et donc la capacité à lire [2,3,4]. Son évolution se fait avec le vieillissement. Au début, la vision n’est pas affectée mais des dépôts dans la rétine (drusen) se forment. Les drusen sont des dépôts jaunes localisés, cliniquement visibles, de matière extracellulaire polymorphe à l’interface entre l’EPR et la zone collagénique interne de la membrane de Bruch. Elle est généralement bilatérale, mais un œil peut être touché avant l’autre. La DMLA est divisée en deux groupes différents. Le premier est la DMLA sèche où aucune néoangiogenèse n’est visible. La seconde est la DMLA humide, plus agressive, avec des néovaisseaux choroïdiens. Cette croissance anormale des vaisseaux de la vascularisation choroïdienne vers la rétine neurosensorielle à travers la membrane de Bruch est responsable de l’hématome et de la destruction de la macula. Ils peuvent être occultes et mieux vus par l’angiographie à la fluorescéine [5].
L’hyperosmolalité du segment postérieur provoque des changements métaboliques qui sont à leur tour responsables d’une glycolyse aérobie avec une sécrétion accrue de lactate par les cellules gliales de Muller, qui vont nourrir les cellules rétiniennes. L’hyperosmolarité entraîne également une néoangiogenèse [6,7]. La rétine ne peut pas métaboliser cet excès de lactate, ce qui entraîne un pH intracellulaire acide, un dysfonctionnement synaptique, des dépôts extracellulaires (drusen) et finalement l’apoptose [8]. Par conséquent, nous suggérons que la DMLA peut être considérée comme une défaillance mitochondriale secondaire à une inflammation et à une maladie métabolique.
2. L’inflammation est le moteur de la DMLA
Une petite proportion des cas de DMLA semble avoir une composante génétique [9]. Ces caractéristiques génétiques sont rares par rapport aux caractéristiques sporadiques les plus courantes. La grande majorité des cas de DMLA sont sporadiques. La DMLA, comme le cancer et la maladie d’Alzheimer, est fortement liée à l’âge [10].
Les personnes âgées expriment une inflammation systémique de faible niveau [11]. L’inflammation systémique joue un rôle clé dans les maladies du vieillissement [11]. L’inflammation, telle qu’elle est observée dans le processus de vieillissement, est un facteur déterminant dans la plupart des maladies des personnes âgées [12]. Le rôle de l’inflammation dans la DMLA a été partiellement négligé et est caractérisé par l’activation du complément [13]. Il existe de rares rapports sur son importance, mais aucune explication claire sur son rôle central dans cette maladie [14]. Un autre indice du lien entre la MA et la DMLA est la présence de bêta-amyloïde dans les drusen [15].
L’activation des inflammasomes chez les patients atteints de DMLA entraîne une néovascularisation de la rétine [16]. La protéine C-réactive, située dans les drusen de la couche basale de la choroïde, régule les plaquettes et les monocytes activés, participe aux voies inflammatoires et détruit les cellules choroïdiennes [17,18].
Les monocytes spléniques jouent un rôle dans l’infiltration choriorétinienne, et la suppression par des antagonistes du récepteur de l’angiotensine II (ATR1) et la splénectomie réduisent l’accumulation sous-rétinienne de phagocytes mononucléaires et le développement anormal de la néovascularisation choroïdienne. Chez les souris âgées exprimant l’apolipoprotéine E-2 (ApoE2), un modèle de DMLA chronique, les antagonistes du récepteur ATR1 et la splénectomie réduisent également l’inflammation rétinienne chronique et la dégénérescence concomitante des cônes chez ces souris. Des niveaux plus élevés d’angiotensine II dans le plasma ont été déterminés dans la DMLA, ce qui confirme le rôle clé de l’inflammation [19].
Une dégénérescence rétinienne et une réponse cytokinique accrues dans un modèle murin de dégénérescence maculaire liée à l’âge (DMLA) ont été démontrées dans le contexte d’une inflammation systémique due à la polyarthrite rhumatoïde (PR). Cette étude a examiné l’effet de l’inhibition de l’histone désacétylase (HDAC) sur la progression de la DMLA en présence d’une inflammation systémique [20]. L’inhibition des HDAC a minimisé l’effet cumulatif de la dégénérescence rétinienne induite par le NaIO3 en présence d’une inflammation systémique causée par l’arthrite induite par le collagène (CIA), telle qu’évaluée par tomographie par cohérence optique (OCT). En outre, l’inhibition des HDAC chez les souris traitées par CIA + iodate de sodium (NaIO3) a réduit la production de cytokines. Ces résultats indiquent le potentiel thérapeutique des inhibiteurs d’HDAC pour le traitement de la DMLA sèche [20].
3. L’augmentation de l’osmolalité comme moteur de la DMLA
L’inflammation est une caractéristique clinique qui peut être causée par des facteurs aussi divers que la chaleur, le gel, un traumatisme ou de multiples produits chimiques entraînant une fuite vasculaire [21,22]. L’inflammation (une caractéristique clinique) est étroitement liée, voire synonyme, d’hyperosmolalité (une caractéristique physique) [23,24].
La pression osmotique a été découverte par Jean Antoine Nollet en 1748. Son rôle a surtout été étudié en physiologie. La pression sanguine permet à l’eau et aux petites molécules telles que le glucose d’être évacuées hors des capillaires et d’alimenter les cellules de l’organisme. Dans les tissus sains, les macromolécules (telles que les grosses protéines) ne peuvent pas s’écouler en dehors des capillaires, ce qui crée un gradient osmotique. Ce gradient est responsable du retour de l’eau dans la circulation veineuse. De même, dans le rein, la plupart des protéines ne peuvent pas passer dans le filtrat, ce qui entraîne le mouvement de l’eau hors de la capsule vers le glomérule. L’osmolarité est responsable du retour de la plupart de l’eau vers la circulation sanguine [25].
Le rôle de la pression osmotique ne se limite pas à la physiologie normale, mais joue également un rôle essentiel dans de nombreuses maladies. Le liquide extracellulaire contient peu ou pas de protéines. L’osmolarité est d’environ 300 mOsm/L. La plupart des protéines sont confinées dans l’espace vasculaire où l’osmolarité est plus élevée (330 mOsm/L). En cas d’inflammation, il y a toujours une fuite vasculaire et les protéines sont alors présentes dans l’espace extracellulaire. Les modèles animaux d’inflammation démontrent que dans les fluides inflammatoires, quelle qu’en soit la cause, il y a une teneur en protéines, ce qui entraîne une augmentation de l’osmolarité. L’augmentation de l’osmolarité entraîne une inflammation. L’augmentation de l’osmolarité extracellulaire stimule la synthèse de cytokines, telles que les interleukines ou le TNF alpha, et entraîne la prolifération et l’activation des cellules immunitaires [23].
Il existe des preuves substantielles de l’implication de la pression osmotique/hyperosmolarité dans la DMLA. Une corrélation positive significative a été trouvée entre la réduction de la pression osmotique des colloïdes plasmatiques (COP) et l’amélioration du champ visuel dans la DMLA non exsudative ou sèche. Par conséquent, la modification du niveau plasmatique de la COP peut aider les patients atteints de DMLA [26]. Il a également été démontré que le stress hyperosmotique a plusieurs effets sur les cellules de l’EPR [27]. Ces effets comprennent l’accumulation d’osmolyte organique dans les cellules de l’EPR [28], le réarrangement du cytosquelette [29], l’arrêt du cycle cellulaire, l’augmentation du volume régulateur [30] et l’altération des caractéristiques électriques de l’EPR [31].
Il a été démontré que l’accumulation d’osmolytes organiques intracellulaires dans les cellules de l’EPR est une conséquence primaire du stress hyperosmolaire. Par conséquent, il y a une augmentation de la concentration intracellulaire de sorbitol, agissant comme un osmolyte pour protéger les cellules du rétrécissement cellulaire induit par l’hyperosmose [27,32]. Le réarrangement du cytosquelette est un autre effet du stress hyperosmolaire sur les cellules de l’EPR. Le stress hyperosmotique appliqué aux cellules de l’EPR de lapin cultivées a augmenté l’expression de la lysyl oxydase, une amine oxydase extracellulaire qui dirige la maturation du collagène et de l’élastine. La force de cohésion entre l’EPR et la membrane de Bruch peut provenir de leur interaction, et la lysyl oxydase générée dans les cellules de l’EPR peut jouer un rôle dans cette interaction [27,29]. En outre, le stress hyperosmolaire a conduit à l’arrêt du cycle cellulaire dans la lignée cellulaire ARPE-19 dérivée de l’EPR humaine par le biais d’un sous-ensemble de gènes régulés identifiés par le profilage de l’expression génique dans ces cellules [8,27]. En outre, la régulation du volume cellulaire est un autre résultat du stress hyperosmolaire sur les EPR. L’augmentation du volume régulateur (RVI) a été provoquée par le rétrécissement induit par l’hyperosmolarité de l’EPR humain et de l’EPR de grenouille [30,33]. En outre, le stress hyperosmolaire a réduit la résistance électrique transépithéliale (TER) de l’EPR bovin lorsqu’il est appliqué sur le côté apical des épithéliums [27,31]. D’autre part, plusieurs autres effets ont été documentés en ce qui concerne les facteurs de croissance angiogéniques. L’hyperosmolarité stimule la transcription du gène du facteur de croissance basique des fibroblastes (bFGF) et du facteur de croissance similaire à l’EGF lié à l’héparine (HB-EGF), ainsi que la sécrétion de bFGF par les cellules de l’EPR. Il a été suggéré qu’un apport élevé en sel alimentaire qui provoque un stress osmotique peut exacerber les troubles rétiniens néovasculaires en stimulant la synthèse des facteurs angiogéniques dans les cellules de l’EPR [7]. En effet, il a été suggéré que la consommation excessive de sel dans le régime alimentaire, qui augmente l’osmolarité extracellulaire [34,35], peut affecter les cellules de l’EPR directement et indépendamment de l’hypertension. Parmi ces effets, on peut citer l’augmentation de l’expression de l’IL-1β et l’expression génétique de plusieurs facteurs angiogéniques [7]. La génération de facteurs angiogéniques déclenchée par le sel pourrait potentiellement accélérer la progression de la néovascularisation et de l’œdème choroïdiens, tandis que l’IL-1β pourrait potentiellement exacerber l’inflammation rétinienne liée à la DMLA [7]. En outre, l’hyperosmolarité déclenche la transcription des gènes de l’aquaporine-5 (AQP5), de l’aquaporine-8 (AQP8) et du facteur de croissance de l’endothélium vasculaire (VEGF), ce qui entraîne la sécrétion de VEGF par les cellules de l’EPR. Un régime riche en sel qui provoque un stress osmotique peut exacerber les troubles rétiniens néovasculaires et l’œdème en incitant l’EPR à produire davantage de VEGF. En outre, dans des conditions hypoxiques, la régulation négative de l’AQP5 peut entraver l’élimination de l’œdème [36].
4. Osmose dans le segment antérieur
Le rôle de l’osmolalité a été démontré dans les pathologies du segment antérieur de l’œil, comme la sécheresse oculaire [37]. Il a été démontré que l’osmolarité des larmes est le paramètre unique le plus utile pour diagnostiquer et classer les conditions de sécheresse oculaire [37]. L’osmolarité des larmes a surpassé les six autres tests en termes de précision diagnostique. Le seuil le plus sensible entre les patients normaux et les patients légers ou modérés s’est avéré être de 308 mOsms/L, tandis que le plus spécifique était de 315 mOsms/L pour l’ulcération de la cornée [38]. Il a été suggéré qu’une plus grande largeur de la fissure palpébrale favorise l’évaporation du film lacrymal, augmentant l’osmolarité du film lacrymal et provoquant des lésions de la surface oculaire et le glaucome [39]. La cataracte peut également être causée par l’hyperosmolalité [40]. Le glaucome est connu pour être causé par une hyperosmolarité locale [41].
Le segment postérieur de l’œil a l’un des taux métaboliques les plus élevés de l’organisme, nécessitant un apport important d’oxygène et d’autres nutriments [42]. Alors que l’artère centrale de la rétine assure l’approvisionnement en sang de la rétine interne, la majeure partie de sa demande en oxygène (sept fois supérieure à celle du cerveau par unité de masse) est fournie par diffusion à partir de la choroïde sous-jacente, qui est le seul approvisionnement de la fovéa avasculaire. La choroïde a le taux le plus élevé de flux sanguin par poids de tous les tissus [43]. La choroïde, en raison de son flux sanguin intense et de la perméabilité de la membrane de Bruch (BM), joue un rôle majeur dans la thermorégulation de la macula. La couche la plus interne de la choroïde est la membrane de Bruch, un feuillet élastique de 2 à 4 μm d’épaisseur. À un jeune âge, elle est perméable aux liquides, aux ions et aux petites protéines [44].
Il existe des preuves d’un phénomène de dialyse dans l’œil. Comme dans une cartouche de rein artificiel, où il y a une circulation concomitante de sang artériel et de dialysat, la circulation des fluides choroïdiens et rétiniens est séparée par la membrane de Bruch. La membrane de Bruch est semi-perméable et cette membrane est formée de protéines glyquées telles que l’héparine. Le débit des artères choroïdiennes est environ 10 à 20 fois supérieur au débit des artères rétiniennes [43,45], ce qui augmente la pression hydrostatique dans la rétine.
5. Vieillissement du segment postérieur : Modifications vasculaires
Au cours du vieillissement, il y a une nette diminution de la perfusion de la choroïde. L’épaisseur normale de la choroïde, mesurée chez les jeunes emmétropes (<27 ans) par EDI-OCT, varie de 264 à 436 µ [46]. Elle diminue de 15,6 µm par décennie [47,48]. La membrane de Bruch s’épaissit, modifiant encore les échanges [44]. Le flux sanguin choroïdien diminue, de même que la porosité de la membrane de Bruch. La diminution de la perfusion entraîne une ischémie et, par conséquent, une altération des propriétés antioxydantes cellulaires hémodynamiques de l’épithélium pigmentaire rétinien (EPR). L’épithélium pigmentaire rétinien (EPR) est incapable de gérer de manière adéquate ce stress oxydatif accru, soit par la synthèse apicale de pseudo-drouille réticulaire (SPR), également appelée dépôts sous-rétiniens de drusénoïdes (SDD), soit par l’exocytose basale plus courante de multiples drusénoïdes composés de lipofuscine et de bis rétinoïdes [13].
The retinal pigment epithelium (RPE) separates the retinal (apical) and choroidal (basal) environments and contributes to the blood–retinal barrier (BRB), which provides a proper environment for photoreceptor cells. The osmolality on the choroidal side is higher than on the retinal side in physiological conditions [49]. Thus, the osmotic gradient from the apical to basal sides is thought to elevate transepithelial electric resistance (TER). TER reflects ion permeability across the epithelia [50]. So, gradients illustrate the direction of epithelial function or pathological changes according to apical and basal osmotic conditions through hydrostatic pressure (HP) [49]. The accumulation of these multiple deposits and wastes of various molecules will also result in a significant increase in osmolarity [23].
6. Increased Osmolarity and AMD
To the best of our knowledge, osmolarity has not been measured in any pathology of the posterior segment, but there is indirect and direct evidence of its importance in AMD. AMD is characterized by multiple features, such as infiltration of the retina by inflammatory cells, proliferation of fibroblasts, and new blood vessel formation. In the neovascular subfoveal membranes, the proliferation of fibroblasts results in the formation of a conjunctival tissue incorporating the new vessel network [51].
The secretion of vascular growth factors that leads to wet macular degeneration by the retinal human pigment cells is increased by osmolarity [7,36]. Retinal detachment can be induced by the intravitreal injection of a hyperosmotic solution [52]. Fibroblast proliferation could be a consequence of increased osmolarity [53].
The best demonstration of the key role of osmolarity in AMD comes from animal models [54]. The retina can be damaged by either blue light or a laser. This results in vascular damage and, in turn, increased osmolarity because of an extravascular protein leak. Polyethylene glycol (PEG) is a chemically inert but osmotically active chemical. PEG is not metabolized in vivo [55]. The subretinal injection of PEG results in choroidal neovascularization [55] and the formation of structures resembling drusen [56], resulting in the loss of photoreceptors. There is cell death and atrophy, as is seen in AMD. The formation of choroidal neovascularization (CNV) in PEG-treated mice indicates that PEG can be used to induce CNV. In vitro, human adult retinal pigment epithelial-19 (ARPE-19) cells were treated with various doses of PEG and experienced cell death. However, the authors failed to link PEG to the osmolarity. Similarly, the intravitreous injection of hyperosmolar mannitol results in serous retinal detachment [55,56].
7. Metabolic Shift Induced by Increased Pressure
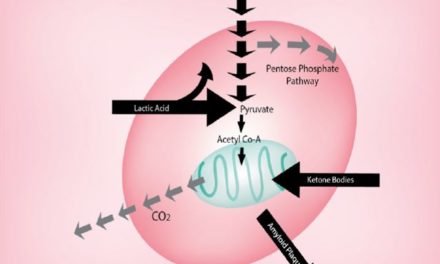
To perform their normal physiological functions, cells must maintain an intracellular pH (pHi) within the physiological range. Intracellular enzyme activity, cytoskeleton component integration, and cellular growth and differentiation rates are all closely associated with pHi [57]. A fall in pHi decreases neuronal activity and is responsible for apoptosis [58].
Dans la maladie d’Alzheimer, on observe une évolution vers l’acidose intracellulaire et l’apoptose. Il a été démontré que les neurones se nourrissent du lactate sécrété par les cellules gliales [59]. Dans le cas de la maladie d’Alzheimer, on observe une augmentation de la sécrétion de lactate, mesurée par le liquide céphalo-rachidien [60].
L’augmentation de la sécrétion de lactate par les cellules gliales entraîne une augmentation de l’absorption par les neurones et une acidose intracellulaire [59]. Il s’agit de l’inverse de l’effet Warburg, décrit pour la première fois par [61]. La chute du pHi peut entraîner la mort des cellules neuronales.
Un scénario similaire est probablement en jeu dans la DMLA. Les neurones se nourrissent du lactate libéré par les cellules gliales et, de la même manière, les cellules rétiniennes se nourrissent du lactate libéré par les cellules de Muller [62]. Ces dernières, semblables aux cellules gliales du cerveau, métabolisent le glucose en lactate, qui est préférentiellement absorbé par les photorécepteurs comme carburant pour leur métabolisme oxydatif [63]. Même en présence de glucose et d’oxygène, les cellules de Müller humaines cultivées obtiennent la majeure partie de leur ATP à partir de la glycolyse aérobie et affichent un faible taux de consommation d’oxygène [64]. Elles alimentent les cellules rétiniennes en lactate. En effet, l’augmentation de la sécrétion de lactate va avoir de multiples conséquences : augmentation de la sécrétion urinaire de lactate [65] et augmentation de la sécrétion de marqueurs de l’inflammation [66] et de VEGF [67]. Le pH acide joue un rôle crucial dans la mort des cellules rétiniennes [68].
L’inflammation augmente la sécrétion de lactate, ce qui entraîne une augmentation des niveaux de lactate dans le sérum et l’urine [69,70]. Il a été démontré qu’en réponse à un stress osmotique, les cellules présentent un remodelage métabolique aigu via le contrôle de la phosphorylation de la pyruvate déshydrogénase par la détection directe de l’osmose dans les mitochondries [71]. Tableau 1 résume les caractéristiques métaboliques de la DMLA.
Les corrélations entre l’inflammation, l’hyperosmolarité et les changements métaboliques dans la DMLA sont présentées dans la figure 1.
8. Nouvelles approches thérapeutiques de la DMLA
Il existe très peu de données sur les voies métaboliques impliquées dans la DMLA. Les activités enzymatiques cruciales de la plupart des enzymes de la glycolyse et des mitochondries n’ont pas été mesurées. Cependant, il a été récemment démontré que l’homocystéine provoque un changement métabolique de la respiration mitochondriale vers un taux élevé de glycolyse dans les cellules de l’EPR dans la DMLA [72]. Dans les cellules de l’EPR traitées à l’homocystéine, la glycolyse a été réduite en bloquant les récepteurs N-méthyl-D-aspartate (NMDAR) ou en inhibant GLUT-1. Par conséquent, les NMDAR ou la glycolyse pourraient constituer une nouvelle stratégie de traitement de la DMLA [72].
De plus, certains auteurs ont ciblé le stress oxydatif induit dans les cellules de l’EPR [73]. La dégénérescence des cellules de l’EPR liée à la pathogenèse de la DMLA est principalement causée par le stress oxydatif. La dégénérescence maculaire liée à l’âge (DMLA) est associée à la transition épithéliale-mésenchymateuse (TEM) des cellules de l’épithélium pigmentaire rétinien (EPR). Il a été démontré que ERK est un régulateur important de plusieurs voies de signalisation induites par NaIO3 qui coordonnent le programme de transition épithélio-mésenchymateuse (EMT) dans les cellules de l’EPR. Les auteurs ont démontré que l’inhibition de l’ERK pourrait être une méthode thérapeutique potentielle pour traiter la DMLA [73].
La plupart des traitements ne visent pas la cause première de la DMLA, mais le traitement symptomatique de la DMLA à néovaisseaux par laser [74]. D’autres médicaments inhibent le processus néoangiogénique par injection intravitréenne de médicaments, tels que le Lucentis, qui cible le facteur de croissance VEGF [75]. Cependant, la résistance aux anti-VEGF a été documentée [69]. D’autre part, le traitement de la DMLA sèche est resté insaisissable jusqu’à présent, mais de nombreux essais cliniques sont en cours [76].
Certains auteurs préconisent d’adopter un régime cétogène. La mise en place du régime cétogène est basée sur l’observation clinique que le jeûne avait des effets bénéfiques dans le contrôle des crises d’épilepsie [77]. L’approche nutritionnelle cétogène se caractérise par la consommation d’aliments à forte teneur en graisses et de quantités adéquates de protéines pour la croissance, mais de niveaux insuffisants d’hydrates de carbone pour les besoins métaboliques, forçant ainsi le corps à utiliser principalement les graisses comme source de carburant pour l’œil [78]. À ce jour, aucun essai clinique n’étudie l’effet d’un régime cétogène sur les patients atteints de DMLA, bien que des recherches sur des modèles de souris et de poisson zèbre aient révélé des rôles neuroprotecteurs potentiels du régime cétogène et/ou de ses dérivés [79,80].
Ryals et al, 2020 [81] ont examiné la dégénérescence rétinienne dans un modèle de souris (rd 10) de dégénérescence des photorécepteurs et ont démontré que seule une combinaison d’un régime cétogène et d’un régime pauvre en protéines produisait des résultats bénéfiques. Les souris rd10 soumises au régime combiné présentaient des réponses à l’électrorétinogramme (ERG) significativement plus élevées, comme en témoigne la multiplication par 1,8 de la réponse phototropique à l’onde b et de la réponse scotopique à l’onde a (indiquant les photorécepteurs à bâtonnets et le fonctionnement visuel dans l’obscurité). Ce régime combiné a permis de multiplier par près de deux la couche de photorécepteurs, ce qui indique une amélioration de la fonction et de la survie des photorécepteurs [81]. Ces études pourraient étayer l’idée qu’un régime cétogène peut potentiellement aider à préserver la vue dans la DMLA [79,80].
Dans la DMLA, la supplémentation en acide lipoïque améliore la vision à long terme [82], ce qui suggère le rôle clé de la pyruvate déshydrogénase. Au total, 100 patients atteints de DMLA sèche (âgés de 60 à 83 ans) ont été répartis au hasard entre un groupe de traitement à l’acide lipoïque (AL) (n = 50) et un groupe témoin sous placebo (n = 50). Ces résultats indiquent que le traitement à l’acide lipoïque améliore la qualité de vie liée à la vision chez les patients atteints de DMLA sèche, probablement en améliorant les flux métaboliques. Le bleu de méthylène, un médicament centenaire, peut recevoir deux électrons du NADH en présence du complexe I et les donner au cytochrome C, fournissant une voie alternative de transfert d’électrons dans les mitochondries défectueuses [83]. Le bleu de méthylène est une phénothiazine autoxydable qui possède de puissantes propriétés oxydantes et d’amélioration du métabolisme. Le bleu de méthylène est réduit en acceptant les électrons des donneurs de transport d’électrons réduits et le bleu de méthylène transfère les électrons à l’oxygène pour former de l’eau, maintenant ainsi l’activité de la chaîne de transport d’électrons [84]. En outre, le bleu de méthylène diminue l’effet de Warburg induit par une augmentation de l’osmolarité et réduit la sécrétion de lactate [85].
9. Conclusions
Ces travaux suggèrent fortement que la dégénérescence maculaire, tout comme l’inflammation, est une conséquence directe de l’augmentation de l’osmolarité. Chez l’animal, les médicaments qui induisent l’hyperosmolarité provoquent la DMLA. L’hyperosmolarité entraîne une acidose intracellulaire et l’apoptose. Le traitement doit viser à normaliser la pression et à limiter les conséquences métaboliques de l’augmentation de la pression. Les médicaments normalisant les anomalies métaboliques dans la DMLA, tels que le bleu de méthylène et l’acide α-lipoïque, semblent prometteurs.
Contributions des auteurs
L.S. a rédigé le manuscrit ; M.H. a participé à la conceptualisation de l’article ; A.B. a participé à la rédaction et à la révision du manuscrit ; J.S. a effectué une lecture critique du manuscrit. Tous les auteurs ont lu et approuvé la version publiée du manuscrit.
Financement
Les auteurs déclarent ne pas avoir reçu de fonds, de subventions ou d’autres formes de soutien pendant la préparation de ce manuscrit.
Remerciements
Les auteurs tiennent à remercier Romain Attal, Ricard Luscan et Vincent Fleury pour leur aide. Nous reconnaissons également l’utilisation de l’outil de paraphrase QuillBot AI Paraphrasing Tool (https://quillbot.com/paraphrasing-tool consulté le 11 juin 2024) pour la paraphrase et la vérification grammaticale.
Conflits d’intérêts
Les auteurs déclarent que la recherche a été menée sans aucune relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Références
- Fleckenstein, M. ; Schmitz-Valckenberg, S. ; Chakravarthy, U. Dégénérescence maculaire liée à l’âge : A Review. JAMA 2024, 331, 147-157. [Google Scholar] [CrossRef] [PubMed]
- Colijn, J.M. ; Buitendijk, G.H. ; Prokofyeva, E. ; Alves, D. ; Cachulo, M.L. ; Khawaja, A.P. ; Cougnard-Gregoire, A. ; Merle, B.M. ; Korb, C. ; Erke, M.G. Prévalence de la dégénérescence maculaire liée à l’âge en Europe : Le passé et l’avenir. Ophthalmology 2017, 124, 1753-1763. [Google Scholar] [CrossRef] [PubMed]
- Al-Zamil, W.M. ; Yassin, S.A. Développements récents dans la dégénérescence maculaire liée à l’âge : A Review. Clin. Interv. Aging 2017, 12, 1313-1330. [Google Scholar] [CrossRef] [PubMed]
- Buitendijk, G.H. ; Rochtchina, E. ; Myers, C. ; van Duijn, C.M. ; Lee, K.E. ; Klein, B.E. ; Meuer, S.M. ; de Jong, P.T. ; Holliday, E.G. ; Tan, A.G. Prediction of Age-Related Macular Degeneration in the General Population : The Three Continent AMD Consortium. Ophthalmology 2013, 120, 2644-2655. [Google Scholar] [CrossRef]
- Hrishikesh, V. ; Pranaykumar, S. Age-Related Macular Degeneration : Épidémiologie, physiopathologie, diagnostic et traitement. Cureus 2022, 14, e29583. [Google Scholar]
- Madonna, R. ; Giovannelli, G. ; Confalone, P. ; Renna, F.V. ; Geng, Y.-J. ; De Caterina, R. High Glucose-Induced Hyperosmolarity Contributes to COX-2 Expression and Angiogenesis : Implications pour la rétinopathie diabétique. Cardiovasc. Diabetol. 2016, 15, 18. [Google Scholar] [CrossRef]
- Veltmann, M. ; Hollborn, M. ; Reichenbach, A. ; Wiedemann, P. ; Kohen, L. ; Bringmann, A. Induction osmotique de l’expression du facteur de croissance angiogénique dans les cellules épithéliales du pigment rétinien humain. PLoS ONE 2016, 11, e0147312. [Google Scholar] [CrossRef]
- Arsenijevic, T. ; Vujovic, A. ; Libert, F. ; Op de Beeck, A. ; Hebrant, A. ; Janssens, S. ; Grégoire, F. ; Lefort, A. ; Bolaky, N. ; Perret, J. Le stress hyperosmotique induit un arrêt du cycle cellulaire dans les cellules épithéliales pigmentées de la rétine. Cell Death Dis. 2013, 4, e662. [Google Scholar] [CrossRef]
- Haddad, S. ; Chen, C.A. ; Santangelo, S.L. ; Seddon, J.M. The Genetics of Age-Related Macular Degeneration : Un examen des progrès réalisés à ce jour. Surv. Ophthalmol. 2006, 51, 316-363. [Google Scholar] [CrossRef]
- Klein, R. ; Peto, T. ; Bird, A. ; Vannewkirk, M.R. L’épidémiologie de la dégénérescence maculaire liée à l’âge. Am. J. Ophthalmol. 2004, 137, 486-495. [Google Scholar] [CrossRef]
- Pawelec, G. ; Goldeck, D. ; Derhovanessian, E. Inflammation, Ageing and Chronic Disease. Curr. Opin. Immunol. 2014, 29, 23-28. [Google Scholar] [CrossRef] [PubMed]
- Ginaldi, L. ; Mengoli, L.P. ; De Martinis, M. Ostéoporose, inflammation et vieillissement. Handb. Immunosenescence Basic Underst. Clin. Appl. 2009, 1329-1352. [Google Scholar]
- Sparrow, J.R. Bisretinoids of RPE Lipofuscin : Déclenchement de l’activation du complément dans la dégénérescence maculaire liée à l’âge. Inflamm. Retin. Dis. Complement Biol. Pathol. 2010, 63-74. [Google Scholar]
- Telander, D.G. Inflammation et dégénérescence maculaire liée à l’âge (DMLA) ; Taylor & ; Francis : Abingdon, UK, 2011 ; Volume 26, pp. 192-197. [Google Scholar]
- Dentchev, T. ; Milam, A.H. ; Lee, V.M.-Y. ; Trojanowski, J.Q. ; Dunaief, J.L. Amyloid-β Is Found in Drusen from Some Age-Related Macular Degeneration Retinas, but Not in Drusen from Normal Retinas. Am. J. Ophthalmol. 2003, 136, 787. [Google Scholar] [CrossRef]
- Malsy, J. ; Alvarado, A.C. ; Lamontagne, J.O. ; Strittmatter, K. ; Marneros, A.G. Distinct Effects of Complement and of NLRP3-and Non-NLRP3 Inflammasomes for Choroidal Neovascularization. eLife 2020, 9, e60194. [Google Scholar] [CrossRef]
- Braig, D. ; Nero, T.L. ; Koch, H.-G. ; Kaiser, B. ; Wang, X. ; Thiele, J.R. ; Morton, C.J. ; Zeller, J. ; Kiefer, J. ; Potempa, L.A. Transitional Changes in the CRP Structure Lead to the Exposure of Proinflammatory Binding Sites. Nat. Commun. 2017, 8, 14188. [Google Scholar] [CrossRef]
- Chu, L. ; Bi, C. ; Wang, C. ; Zhou, H. La relation entre les compléments et la dégénérescence maculaire liée à l’âge et sa pathogenèse. J. Ophthalmol. 2024, 2024, 6416773. [Google Scholar] [CrossRef]
- Roubeix, C. ; Nous, C. ; Augustin, S. ; Ronning, K.E. ; Mathis, T. ; Blond, F. ; Lagouge-Roussey, P. ; Crespo-Garcia, S. ; Sullivan, P.M. ; Gautier, E.L. Splenic Monocytes Drive Pathogenic Subretinal Inflammation in Age-Related Macular Degeneration. J. Neuroinflammation 2024, 21, 22. [Google Scholar] [CrossRef]
- Schnabolk, G. ; Obert, E. ; Singh, S. ; Guzman, W. ; Husain, S. Effet de l’inhibition des HDAC sur un modèle de DMLA sèche en présence d’inflammation systémique. Investig. Ophtalmol. Vis. Sci. 2023, 64, 3909. [Google Scholar]
- Cotran, R.S. ; Majno, G. The Delayed and Prolonged Vascular Leakage in Inflammation : I. Topographie des vaisseaux qui fuient après une blessure thermique. Am. J. Pathol. 1964, 45, 261. [Google Scholar]
- Roviezzo, F. ; Tsigkos, S. ; Kotanidou, A. ; Bucci, M. ; Brancaleone, V. ; Cirino, G. ; Papapetropoulos, A. Angiopoietin-2 Causes Inflammation in Vivo by Promoting Vascular Leakage. J. Pharmacol. Exp. Ther. 2005, 314, 738-744. [Google Scholar] [CrossRef] [PubMed]
- Abolhassani, M. ; Wertz, X. ; Pooya, M. ; Chaumet-Riffaud, P. ; Guais, A. ; Schwartz, L. L’hyperosmolarité provoque l’inflammation par la méthylation de la protéine phosphatase 2A. Inflamm. Res. 2008, 57, 419-429. [Google Scholar] [CrossRef] [PubMed]
- Schwartz, L. ; Guais, A. ; Pooya, M. ; Abolhassani, M. L’inflammation est-elle une conséquence de l’hyperosmolarité extracellulaire ? J. Inflamm. 2009, 6, 21. [Google Scholar] [CrossRef] [PubMed]
- Darwish, A. ; Lui, F. Physiologie, Pression osmotique colloïdale ; StatPearls : Tampa, FL, USA, 2019. [Google Scholar]
- Lüke, C. ; Widder, R.A. ; Walter, P. ; Brunner, R. ; Kirchhof, B. ; Borberg, H. The Effect of Membrane Differential Filtration on the Colloid Osmotic Pressure in Patients with Age-related Macular Degeneration : Signification pour la fonction visuelle ? Ther. Apher. Dial. 2003, 7, 263-268. [Google Scholar] [CrossRef] [PubMed]
- Willermain, F. ; Libert, S. ; Motulsky, E. ; Salik, D. ; Caspers, L. ; Perret, J. ; Delporte, C. Origines et conséquences du stress hyperosmolaire dans les cellules épithéliales pigmentées de la rétine. Front. Physiol. 2014, 5, 199. [Google Scholar] [CrossRef] [PubMed]
- Henry, D.N. ; Frank, R.N. ; Hootman, S.R. ; Rood, S.E. ; Heilig, C.W. ; Busik, J.V. Glucose-Specific Regulation of Aldose Reductase in Human Retinal Pigment Epithelial Cells in Vitro. Investig. Ophtalmol. Vis. Sci. 2000, 41, 1554-1560. [Google Scholar]
- Omori, K. ; Fujiseki, Y. ; Omori, K. ; Suzukawa, J. ; Inagaki, C. Regulation of the Expression of Lysyl Oxidase mRNA in Cultured Rabbit Retinal Pigment Epithelium Cells. Matrix Biol. 2002, 21, 337-348. [Google Scholar] [CrossRef]
- Civan, M. ; Marano, C. ; Matschinsky, F. ; Peterson-Yantorno, K. L’incubation prolongée avec du glucose élevé inhibe la réponse régulatrice au rétrécissement des cellules épithéliales du pigment rétinien humaines cultivées. J. Membr. Biol. 1994, 139, 1-13. [Google Scholar] [CrossRef]
- Orgül, S. ; Reuter, U. ; Kain, H. Stress osmotique dans un modèle in vitro de la barrière hémato-rétinienne externe. Ger. J. Ophthalmol. 1993, 2, 436-443. [Google Scholar]
- Carpene, G. ; Onorato, D. ; Nocini, R. ; Fortunato, G. ; Rizk, J.G. ; Henry, B.M. ; Lippi, G. Blood Lactate Concentration in COVID-19 : Une revue systématique de la littérature. Clin. Chem. Lab. Med. 2022, 60, 332-337. [Google Scholar] [CrossRef]
- Adorante, J.S. ; Miller, S.S. Potassium-Dependent Volume Regulation in Retinal Pigment Epithelium Is Mediated by Na, K, Cl Cotransport. J. Gen. Physiol. 1990, 96, 1153-1176. [Google Scholar] [CrossRef] [PubMed]
- Obika, L.O. ; Amabebe, E. ; Ozoene, J. ; Inneh, C. Thirst Perception, Plasma Osmolality and Estimated Plasma Arginine Vasopressin Concentration in Dehydrated and Oral Saline Loaded Subjects. Niger. J. Physiol. Sci. 2013, 28, 83-89. [Google Scholar] [PubMed]
- He, F.J. ; Markandu, N.D. ; Sagnella, G.A. ; de Wardener, H.E. ; MacGregor, G.A. Plasma Sodium : Ignoré et sous-estimé. Hypertension 2005, 45, 98-102. [Google Scholar] [CrossRef] [PubMed]
- Hollborn, M. ; Vogler, S. ; Reichenbach, A. ; Wiedemann, P. ; Bringmann, A. ; Kohen, L. Regulation of the Hyperosmotic Induction of Aquaporin 5 and VEGF in Retinal Pigment Epithelial Cells : Implication de NFAT5. Mol. Vis. 2015, 21, 360. [Google Scholar] [PubMed]
- Lemp, M.A. ; Bron, A.J. ; Baudouin, C. ; Del Castillo, J.M.B. ; Geffen, D. ; Tauber, J. ; Foulks, G.N. ; Pepose, J.S. ; Sullivan, B.D. Tear Osmolarity in the Diagnosis and Management of Dry Eye Disease. Am. J. Ophthalmol. 2011, 151, 792-798. [Google Scholar] [CrossRef]
- Gilbard, J.P. ; Farris, R.L. Ocular Surface Drying and Tear Film Osmolarity in Thyroid Eye Disease. Acta Ophthalmol. 1983, 61, 108-116. [Google Scholar] [CrossRef]
- Anwar, Z. ; Wellik, S.R. ; Galor, A. Glaucoma Therapy and Ocular Surface Disease : Littérature actuelle et recommandations. Curr. Opin. Ophthalmol. 2013, 24, 136-143. [Google Scholar] [CrossRef]
- Jacob, T. ; Duncan, G. Influences osmotiques sur les caractéristiques de la membrane du cristallin. Exp. Eye Res. 1980, 31, 505-512. [Google Scholar] [CrossRef]
- Asiedu, K. ; Abu, S.L. The Impact of Topical Intraocular Pressure Lowering Medications on the Ocular Surface of Glaucoma Patients : A Review. J. Curr. Ophthalmol. 2019, 31, 8-15. [Google Scholar] [CrossRef]
- Joyal, J.-S. ; Gantner, M.L. ; Smith, L.E. Retinal Energy Demands Control Vascular Supply of the Retina in Development and Disease : Le rôle du métabolisme neuronal des lipides et du glucose. Prog. Retin. Eye Res. 2018, 64, 131-156. [Google Scholar] [CrossRef]
- Alm, A. ; Bill, A. Ocular and Optic Nerve Blood Flow at Normal and Increased Intraocular Pressures in Monkeys (Macaca Irus) : Une étude avec des microsphères marquées radioactivement comprenant des déterminations de débit dans le cerveau et certains autres tissus. Exp. Eye Res. 1973, 15, 15-29. [Google Scholar] [CrossRef] [PubMed]
- Moore, D.J. ; Clover, G.M. L’effet de l’âge sur la perméabilité macromoléculaire de la membrane de Bruch humaine. Investig. Ophtalmol. Vis. Sci. 2001, 42, 2970-2975. [Google Scholar]
- Pournaras, C.J. ; Rungger-Brändle, E. ; Riva, C.E. ; Hardarson, S.H. ; Stefansson, E. Regulation of Retinal Blood Flow in Health and Disease. Prog. Retin. Eye Res. 2008, 27, 284-330. [Google Scholar] [CrossRef] [PubMed]
- Hoseini-Yazdi, H. ; Vincent, S.J. ; Collins, M.J. ; Read, S.A. ; Alonso-Caneiro, D. Wide-Field Choroidal Thickness in Myopes and Emmetropes. Sci. Rep. 2019, 9, 3474. [Google Scholar] [CrossRef]
- Spaide, R.F. ; Koizumi, H. ; Pozonni, M.C. Tomographie par cohérence optique dans le domaine spectral pour l’imagerie en profondeur améliorée. Am. J. Ophthalmol. 2008, 146, 496-500. [Google Scholar] [CrossRef]
- Margolis, R. ; Spaide, R.F. A Pilot Study of Enhanced Depth Imaging Optical Coherence Tomography of the Choroid in Normal Eyes. Am. J. Ophthalmol. 2009, 147, 811-815. [Google Scholar] [CrossRef]
- Tokuda, S. ; Yu, A.S. Regulation of Epithelial Cell Functions by the Osmolality and Hydrostatic Pressure Gradients : Un rôle possible de la jonction serrée en tant que capteur. Int. J. Mol. Sci. 2019, 20, 3513. [Google Scholar] [CrossRef]
- Shirao, Y.; Steinberg, R.H. Mechanisms of Effects of Small Hyperosmotic Gradients on the Chick RPE. Investig. Ophthalmol. Vis. Sci. 1987, 28, 2015–2025. [Google Scholar]
- Kvanta, A.; Algvere, P.; Berglin, L.; Seregard, S. Subfoveal Fibrovascular Membranes in Age-Related Macular Degeneration Express Vascular Endothelial Growth Factor. Investig. Ophthalmol. Vis. Sci. 1996, 37, 1929–1934. [Google Scholar] [CrossRef]
- Marmor, M.F. Retinal Detachment from Hyperosmotic Intravitreal Injection. Investig. Ophthalmol. Vis. Sci. 1979, 18, 1237–1244. [Google Scholar]
- Turner, J.L.; Bierman, E.L. Effects of Glucose and Sorbitol on Proliferation of Cultured Human Skin Fibroblasts and Arterial Smooth-Muscle Cells. Diabetes 1978, 27, 583–588. [Google Scholar] [CrossRef] [PubMed]
- Pennesi, M.E.; Neuringer, M.; Courtney, R.J. Animal Models of Age Related Macular Degeneration. Mol. Asp. Med. 2012, 33, 487–509. [Google Scholar] [CrossRef] [PubMed]
- Lyzogubov, V.V.; Tytarenko, R.G.; Liu, J.; Bora, N.S.; Bora, P.S. Polyethylene Glycol (PEG)-Induced Mouse Model of Choroidal Neovascularization. J. Biol. Chem. 2011, 286, 16229–16237. [Google Scholar] [CrossRef] [PubMed]
- Mitchell, R.; Logan, C.; Lyzogubov, V.V.; Bora, N.S.; Bora, P.S. Wet and Dry Age-Related Macular Degeneration Induced by Polyethylene Glycol. Preprints 2023, 2023071318, V1. [Google Scholar]
- Christen, R.; Schackmann, R.; Shapiro, B. Metabolism of Sea Urchin Sperm. Interrelationships between Intracellular pH, ATPase Activity, and Mitochondrial Respiration. J. Biol. Chem. 1983, 258, 5392–5399. [Google Scholar] [CrossRef]
- Sinning, A.; Hübner, C.A. Minireview: pH and Synaptic Transmission. FEBS Lett. 2013, 587, 1923–1928. [Google Scholar] [CrossRef]
- Schwartz, L.; Peres, S.; Jolicoeur, M.; da Veiga Moreira, J. Cancer and Alzheimer’s Disease: Intracellular pH Scales the Metabolic Disorders. Biogerontology 2020, 21, 683–694. [Google Scholar] [CrossRef]
- Zebhauser, P.T.; Berthele, A.; Goldhardt, O.; Diehl-Schmid, J.; Priller, J.; Ortner, M.; Grimmer, T. Cerebrospinal Fluid Lactate Levels along the Alzheimer’s Disease Continuum and Associations with Blood-Brain Barrier Integrity, Age, Cognition, and Biomarkers. Alzheimer Res. Ther. 2022, 14, 1–8. [Google Scholar]
- Demetrius, L.A. ; Simon, D.K. Un effet Inverse-Warburg et l’origine de la maladie d’Alzheimer. Biogerontology 2012, 13, 583-594. [Google Scholar] [CrossRef]
- Poitry-Yamate, C.L. ; Poitry, S. ; Tsacopoulos, M. Le lactate libéré par les cellules gliales de Muller est métabolisé par les photorécepteurs de la rétine de mammifère. J. Neurosci. 1995, 15, 5179-5191. [Google Scholar] [CrossRef]
- Ng, S.K. ; Wood, J.P. ; Chidlow, G. ; Han, G. ; Kittipassorn, T. ; Peet, D.J. ; Casson, R.J. Cancer-like Metabolism of the Mammalian Retina. Clin. Exp. Ophthalmol. 2015, 43, 367-376. [Google Scholar] [CrossRef] [PubMed]
- Bringmann, A. ; Reichenbach, A. Rôle des cellules de Muller dans les dégénérescences rétiniennes. Front. Biosci. 2001, 6, 77-92. [Google Scholar] [CrossRef] [PubMed]
- Yokosako, K. ; Mimura, T. ; Funatsu, H. ; Noma, H. ; Goto, M. ; Kamei, Y. ; Kondo, A. ; Matsubara, M. Glycolysis in Patients with Age-Related Macular Degeneration (Glycolyse chez les patients atteints de dégénérescence maculaire liée à l’âge). Open Ophthalmol. J. 2014, 8, 39. [Google Scholar] [CrossRef] [PubMed]
- Dhup, S. ; Kumar Dadhich, R. ; Ettore Porporato, P. ; Sonveaux, P. Activités biologiques multiples de l’acide lactique dans le cancer : Influences sur la croissance tumorale, l’angiogenèse et les métastases. Curr. Pharm. Des. 2012, 18, 1319-1330. [Google Scholar] [CrossRef]
- Yang, S. ; Zhao, J. ; Sun, X. Resistance to Anti-VEGF Therapy in Neovascular Age-Related Macular Degeneration : A Comprehensive Review. Drug Des. Dev. Ther. 2016, 10, 1857-1867. [Google Scholar]
- Reber, F. ; Kasper, M. ; Siegner, A. ; Kniep, E. ; Seigel, G. ; Funk, R.H. Alteration of the Intracellular pH and Apoptosis Induction in a Retinal Cell Line by the AGE-Inducing Agent Glyoxal. Graefe’s Arch. Clin. Exp. Ophthalmol. 2002, 240, 1022-1032. [Google Scholar] [CrossRef]
- Kumar, A. ; Haery, C. ; Paladugu, B. ; Kumar, A. ; Symeoneides, S. ; Taiberg, L. ; Osman, J. ; Trenholme, G. ; Opal, S.M. ; Goldfarb, R. La durée de l’hypotension avant le début du traitement antibiotique est un facteur déterminant de la survie dans un modèle murin de choc septique à Escherichia Coli : association avec les niveaux de lactate sérique et de cytokines inflammatoires. J. Infect. Dis. 2006, 193, 251-258. [Google Scholar] [CrossRef]
- Marcoux, J. ; McArthur, D.A. ; Miller, C. ; Glenn, T.C. ; Villablanca, P. ; Martin, N.A. ; Hovda, D.A. ; Alger, J.R. ; Vespa, P.M. Persistent Metabolic Crisis as Measured by Elevated Cerebral Microdialysis Lactate-Pyruvate Ratio Predicts Chronic Frontal Lobe Brain Atrophy after Traumatic Brain Injury. Crit. Care Med. 2008, 36, 2871-2877. [Google Scholar] [CrossRef]
- Ikizawa, T. ; Ikeda, K. ; Arita, M. ; Kitajima, S. ; Soga, T. ; Ichijo, H. ; Naguro, I. Les mitochondries détectent directement le stress osmotique pour déclencher un remodelage métabolique rapide via la régulation de la phosphorylation de la pyruvate déshydrogénase. J. Biol. Chem. 2023, 299, 102837. [Google Scholar] [CrossRef]
- Samra, Y.A. ; Zaidi, Y. ; Rajpurohit, P. ; Raghavan, R. ; Cai, L. ; Kaddour-Djebbar, I. ; Tawfik, A. Warburg Effect as a Novel Mechanism for Homocysteine-Induced Features of Age-Related Macular Degeneration. Int. J. Mol. Sci. 2023, 24, 1071. [Google Scholar] [CrossRef]
- Yang, Y.-C. ; Chien, Y. ; Yarmishyn, A.A. ; Lim, L.-Y. ; Tsai, H.-Y. ; Kuo, W.-C. ; Tsai, P.-H. ; Yang, S.-H. ; Hong, S.-I. ; Chen, S.-J. Inhibition de la transition épithéliale-mésenchymateuse induite par le stress oxydatif dans les cellules épithéliales du pigment rétinien du modèle de dégénérescence maculaire liée à l’âge en supprimant l’activation de l’ERK. J. Adv. Res. 2024, 60, 141-157. [Google Scholar] [CrossRef] [PubMed]
- Groupe d’étude sur la photocoagulation maculaire. Photocoagulation au laser des lésions néovasculaires sous-fovéales dans la dégénérescence maculaire liée à l’âge : Résultats d’un essai clinique randomisé. Arch. Ophthalmol. 1991, 109, 1220-1231. [Google Scholar] [CrossRef] [PubMed]
- Mitchell, P. ; Korobelnik, J.-F. ; Lanzetta, P. ; Holz, F.G. ; Pruente, C. ; Schmidt-Erfurth, U. ; Tano, Y. ; Wolf, S. Ranibizumab (Lucentis) in Neovascular Age-Related Macular Degeneration : Evidence from Clinical Trials. Br. J. Ophthalmol. 2010, 94, 2-13. [Google Scholar] [CrossRef] [PubMed]
- de Guimaraes, T.A.C. ; Varela, M.D. ; Georgiou, M. ; Michaelides, M. Traitements pour la dégénérescence maculaire sèche liée à l’âge : Pistes thérapeutiques, essais cliniques et orientations futures. Br. J. Ophthalmol. 2022, 106, 297-304. [Google Scholar] [CrossRef] [PubMed]
- Evangeliou, A. ; Vlassopoulos, D. Carnitine Metabolism and Deficit-When Supplementation Is Necessary ? Curr. Pharm. Biotechnol. 2003, 4, 211-219. [Google Scholar] [CrossRef]
- Napoli, E. ; Dueñas, N. ; Giulivi, C. Potential Therapeutic Use of the Ketogenic Diet in Autism Spectrum Disorders. Front. Pediatr. 2014, 2, 69. [Google Scholar] [CrossRef]
- Gough, S. ; Casella, A. ; Ortega, K. ; Hackam, A. Neuroprotection by the Ketogenic Diet : Preuves et controverses. Front. Nutr. 2021, 8, 782657. [Google Scholar] [CrossRef]
- Gough, S.M. Effets bénéfiques du régime cétogène et du métabolisme des corps cétoniques dans différents modèles de neurodégénérescence. Thèse de doctorat, Université de Miami, Miami, FL, États-Unis, 2021. [Google Scholar]
- Ryals, R.C. ; Huang, S.J. ; Wafai, D. ; Bernert, C. ; Steele, W. ; Six, M. ; Bonthala, S. ; Titus, H. ; Yang, P. ; Gillingham, M. A Ketogenic & ; Low-Protein Diet Slows Retinal Degeneration in Rd10 Mice. Transl. Vis. Sci. Technol. 2020, 9, 18. [Google Scholar]
- Tao, Y. ; Jiang, P. ; Wei, Y. ; Wang, P. ; Sun, X. ; Wang, H. α-Lipoic Acid Treatment Improves Vision-Related Quality of Life in Patients with Dry Age-Related Macular Degeneration. Tohoku J. Exp. Med. 2016, 240, 209-214. [Google Scholar] [CrossRef]
- Yang, S.-H. ; Li, W. ; Sumien, N. ; Forster, M. ; Simpkins, J.W. ; Liu, R. Alternative Mitochondrial Electron Transfer for the Treatment of Neurodegenerative Diseases and Cancers : Le bleu de méthylène relie les points. Prog. Neurobiol. 2017, 157, 273-291. [Google Scholar] [CrossRef]
- Bruchey, A.K. ; Gonzalez-Lima, F. Behavioral, Physiological and Biochemical Hormetic Responses to the Autoxidizable Dye Methylene Blue. Am. J. Pharmacol. Toxicol. 2008, 3, 72. [Google Scholar] [CrossRef] [PubMed]
- Montegut, L. ; Martinez-Basilio, P.C. ; da Veiga Moreira, J. ; Schwartz, L. ; Jolicoeur, M. La combinaison de l’acide lipoïque et du bleu de méthylène réduit l’effet Warburg dans les cellules CHO : De l’activation du cycle TCA à l’amélioration de la production d’anticorps monoclonaux. PLoS ONE 2020, 15, e0231770. [Google Scholar] [CrossRef] [PubMed]
- Zhang, X. ; Rojas, J.C. ; Gonzalez-Lima, F. Le bleu de méthylène prévient la neurodégénérescence causée par la roténone dans la rétine. Neurotox. Res. 2006, 9, 47-57. [Google Scholar] [CrossRef] [PubMed]
|
Disclaimer/Publisher’s Note: Les déclarations, les opinions et les données contenues dans toutes les publications sont uniquement celles des auteurs individuels et des contributeurs et non celles de MDPI et/ou des éditeurs. MDPI et/ou le(s) rédacteur(s) décline(nt) toute responsabilité en cas de dommages corporels ou matériels résultant d’idées, de méthodes, d’instructions ou de produits mentionnés dans le contenu.
|
© 2024 par les auteurs. Licencié MDPI, Bâle, Suisse. Cet article est un article en libre accès distribué selon les termes et conditions de la licence Creative Commons Attribution (CC BY) (https://creativecommons.org/licenses/by/4.0/).