Voir d’autres articles dans PMC qui citent l’article publié.
Résumé
Contrairement aux cellules différenciées normales, qui dépendent principalement de la phosphorylation oxydative mitochondriale pour générer l’énergie nécessaire aux processus cellulaires, la plupart des cellules cancéreuses dépendent plutôt de la glycolyse aérobie, un phénomène appelé » effet Warburg « . La glycolyse aérobie est un moyen inefficace de produire de l’adénosine 5′-triphosphate (ATP), cependant, l’avantage qu’elle confère aux cellules cancéreuses n’est pas clair. Nous proposons ici que le métabolisme des cellules cancéreuses, et en fait de toutes les cellules proliférantes, soit adapté pour faciliter l’absorption et l’incorporation de nutriments dans la biomasse (p. ex. nucléotides, acides aminés et lipides) nécessaires à la production d’une nouvelle cellule. Cette idée est étayée par des études récentes montrant que (i) plusieurs voies de signalisation impliquées dans la prolifération cellulaire régulent également les voies métaboliques qui incorporent des nutriments dans la biomasse ; et que (ii) certaines mutations associées au cancer permettent aux cellules cancéreuses d’acquérir et de métaboliser les nutriments d’une manière qui favorise la prolifération plutôt qu’une production efficace d’ATP. Une meilleure compréhension des liens mécanistes entre le métabolisme cellulaire et le contrôle de la croissance peut mener à de meilleurs traitements pour le cancer humain.
Pour les organismes unicellulaires tels que les microbes, il y a une pression évolutive pour se reproduire le plus rapidement possible lorsque les nutriments sont disponibles. Leurs systèmes de contrôle métabolique ont évolué pour détecter un apport adéquat de nutriments et canaliser le carbone, l’azote et l’énergie libre nécessaires pour générer les blocs de construction nécessaires à la production d’une nouvelle cellule. Lorsque les nutriments sont rares, les cellules cessent de produire de la biomasse et adaptent leur métabolisme pour extraire le maximum d’énergie libre des ressources disponibles afin de survivre à la période de famine (Fig. 1). Reflétant ces différences fondamentales dans les besoins métaboliques, des mécanismes de régulation distincts ont évolué pour contrôler le métabolisme cellulaire dans les cellules proliférantes et non proliférantes.
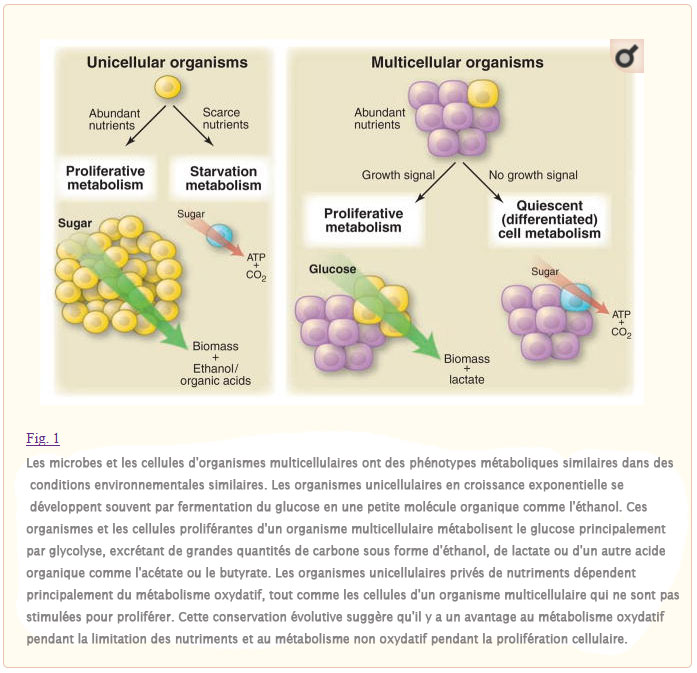
Dans les organismes multicellulaires, la plupart des cellules sont exposées à un apport constant de nutriments. La survie de l’organisme nécessite des systèmes de contrôle qui empêchent la prolifération de cellules individuelles aberrantes lorsque la disponibilité des éléments nutritifs dépasse les niveaux nécessaires pour soutenir la division cellulaire. La prolifération incontrôlée est empêchée parce que les cellules de mammifères n’absorbent normalement pas les nutriments de leur environnement, à moins qu’ils ne soient stimulés à le faire par des facteurs de croissance. Les cellules cancéreuses surmontent cette dépendance au facteur de croissance en acquérant des mutations génétiques qui modifient fonctionnellement les voies de signalisation initiées par les récepteurs. Il est de plus en plus évident que certaines de ces voies activent l’absorption et le métabolisme des nutriments qui favorisent à la fois la survie des cellules et la croissance des piles à combustible (1, 2). Les mutations oncogènes peuvent entraîner l’absorption de nutriments, en particulier le glucose, qui répondent ou dépassent les exigences bioénergétiques de la croissance et de la prolifération cellulaire. Cette prise de conscience a attiré l’attention sur l’observation d’Otto Warburg, en 1924, selon laquelle les cellules cancéreuses métabolisent le glucose d’une manière distincte de celle des cellules dans les tissus normaux (3, 4). En examinant comment les observations de Louis Pasteur concernant la fermentation du glucose en éthanol pourraient s’appliquer aux tissus de mammifères, Warburg a constaté que, contrairement à la plupart des tissus normaux, les cellules cancéreuses ont tendance à « fermenter » le glucose en lactate même en présence d’une quantité suffisante d’oxygène pour soutenir la phosphorylation oxydative mitochondriale. Une explication définitive pour l’observation de Warburg est restée insaisissable, du moins en partie parce que les besoins énergétiques de la prolifération cellulaire semblent à première vue mieux satisfaits par le catabolisme complet du glucose en utilisant la phosphorylation oxydative mitochondriale pour maximiser la production d’adénosine 5′-triphosphate (ATP).
Dans cette revue, nous explorons les exigences métaboliques de la prolifération cellulaire afin de comprendre pourquoi les cellules proliférantes métabolisent le glucose par glycolyse aérobie. La connaissance de ce dont les cellules proliférantes ont besoin en termes d’énergie pour produire de la biomasse aidera à éclairer le lien entre les voies de signalisation qui entraînent la croissance cellulaire et la régulation du métabolisme cellulaire.
Les cellules de mammifères proliférantes présentent un métabolisme anabolique.
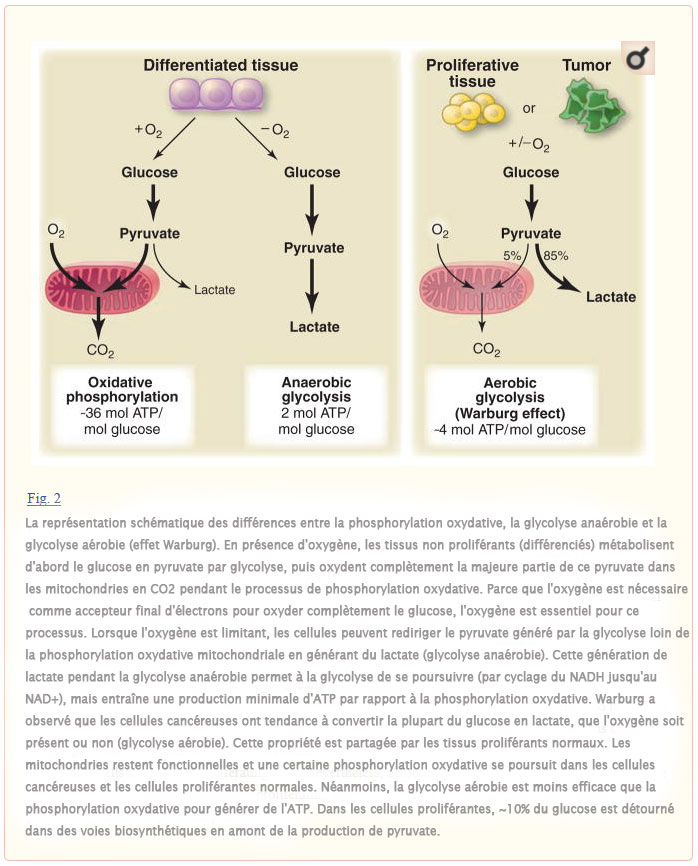
Notre compréhension actuelle des voies métaboliques repose en grande partie sur des études de cellules non proliférantes dans des tissus différenciés. En présence d’oxygène, la plupart des cellules différenciées métabolisent principalement le glucose en dioxyde de carbone par oxydation du pyruvate glycolytique dans le cycle de l’acide tricarboxylique mitochondrial (TCA). Cette réaction produit du NADH[nicotinamide adénine dinucléotide (NAD+), réduit], qui alimente ensuite la phosphorylation oxydative pour maximiser la production d’ATP, avec une production minimale de lactate (Fig. 2). Ce n’est que dans des conditions anaérobies que les cellules différenciées produisent de grandes quantités de lactate. En revanche, la plupart des cellules cancéreuses produisent de grandes quantités de lactate indépendamment de la disponibilité de l’oxygène et, par conséquent, leur métabolisme est souvent appelé « glycolyse aérobie ». Warburg a d’abord émis l’hypothèse que les cellules cancéreuses développent un défaut des mitochondries qui entraîne une altération de la respiration aérobie et une dépendance subséquente au métabolisme glycolytique (4). Cependant, des travaux ultérieurs ont montré que la fonction mitochondriale n’est pas altérée dans la plupart des cellules cancéreuses (5–7), ce qui suggère une explication alternative pour la glycolyse aérobie dans les cellules cancéreuses.
Pourquoi les cellules proliférantes passent-elles à un métabolisme moins efficace ?
Comme indiqué ci-dessus, de nombreux organismes unicellulaires prolifèrent par fermentation, un équivalent microbien de la glycolyse aérobie et analogue aux cellules cancéreuses humaines, et fermentententent de préférence le glucose même lorsque l’oxygène est abondant (Fig. 1). Cela démontre que le métabolisme aérobie glycolytique peut fournir suffisamment d’énergie pour la prolifération cellulaire. Le métabolisme du glucose en lactate ne génère que 2 ATP par molécule de glucose, alors que la phosphorylation oxydative génère jusqu’à 36 ATP lors de l’oxydation complète d’une molécule de glucose (8). Cela soulève la question de savoir pourquoi un métabolisme moins efficace, du moins en termes de production d’ATP, serait choisi pour les cellules proliférantes.
Une explication possible est que la production inefficace d’ATP n’est un problème que lorsque les ressources sont rares. Ce n’est pas le cas des cellules mammifères proliférantes, qui sont exposées à un apport continu de glucose et d’autres nutriments dans le sang circulant. Les voies métaboliques et leur régulation n’ont été étudiées que récemment dans des cellules en prolifération active, et il est prouvé que l’ATP peut ne jamais être limitatif dans ces cellules. Peu importe à quel point ils sont stimulés à se diviser, les cellules utilisant la glycolyse aérobie présentent également des ratios élevés d’ATP/ADP (adénosine 5′-diphosphate) et de NADH/NAD+ (2, 9). De plus, même des perturbations mineures dans le ratio ATP/ADP peuvent nuire à la croissance. Les cellules déficientes en ATP subissent souvent une apoptose (10, 11). Les cellules proliférantes normales peuvent également subir un arrêt du cycle cellulaire et réactiver le métabolisme catabolique lorsque leur capacité à produire de l’ATP à partir du glucose est compromise (12, 13) et qu’il existe des voies de signalisation pour détecter l’état énergétique. La meilleure d’entre elles est initiée par l’activité des adénylate kinases qui tamponnent la production décroissante d’ATP en convertissant deux ADP en une ATP et une AMP (adénosine 5′-monophosphate). Cela aide à maintenir un ratio ATP/ADP viable à mesure que la production d’ATP diminue, mais l’accumulation d’AMP active la protéine kinase activée par l’AMP (AMPK). Cette activation dépend de la protéine suppresseur de tumeur LKB1 et conduit à la phosphorylation de plusieurs cibles pour améliorer la charge énergétique dans les cellules (14). Le LKB1 a d’abord été identifié comme un gène suppresseur de tumeur, ce qui suggère que la capacité de détecter le stress énergétique pourrait être un point de contrôle important pour prévenir la transformation maligne dans certains types de cellules.
Une deuxième explication possible du passage à la glycolyse aérobie, dont il est question en détail ci-dessous, est que les cellules proliférantes ont des besoins métaboliques importants qui vont au-delà de l’ATP.
Croquer les chiffres-Quels sont les besoins métaboliques des cellules proliférantes ?
Pour produire deux cellules filles viables à la mitose, une cellule proliférante doit répliquer tout son contenu cellulaire. Ceci impose un grand besoin de nucléotides, d’acides aminés et de lipides. Pendant la croissance, le glucose est utilisé pour produire de la biomasse ainsi que de l’ATP. Bien que l’hydrolyse de l’ATP fournisse de l’énergie gratuite pour certaines des réactions biochimiques responsables de la réplication de la biomasse, ces réactions ont des exigences supplémentaires. Par exemple, la synthèse du palmitate, un constituant majeur des membranes cellulaires, nécessite 7 molécules d’ATP, 16 carbones de 8 molécules d’acétyl-CoA (coenzyme A) et 28 électrons de 14 molécules de NADPH[nicotinamide adénine dinucléotide phosphate (NADP+), réduit] (8). De même, la synthèse des acides aminés et des nucléotides consomme également plus d’équivalents de carbone et de NADPH que d’ATP. Une molécule de glucose peut générer jusqu’à 36 ATP, ou 30 ATP et 2 NADPH[si elle est détournée dans le shunt phosphate pentose (8, 15)], ou fournir 6 carbones pour la synthèse macromoléculaire. Ainsi, pour former une chaîne acyle grasse à 16 atomes de carbone, une seule molécule de glucose peut fournir cinq fois l’ATP nécessaire, alors que 7 molécules de glucose sont nécessaires pour générer le NADPH requis. Cette asymétrie de 35 fois n’est que partiellement compensée par la consommation de 3 molécules de glucose dans la production d’acétyl-CoA pour satisfaire les besoins en carbone de la chaîne acyle elle-même. Il est clair que pour qu’une cellule prolifère, la majeure partie du glucose ne peut pas être affectée au catabolisme du carbone pour la production d’ATP. En outre, si tel était le cas, l’augmentation du rapport ATP/ADP qui en résulterait compromettrait gravement le flux à travers les intermédiaires glycolytiques, ce qui limiterait la production de l’acétyl-CoA et du NADPH nécessaires à la synthèse macromoléculaire.
Pour la plupart des cellules de mammifères en culture, les deux seules molécules catabolisées en quantités appréciables sont le glucose et la glutamine. Cela signifie que le glucose et la glutamine fournissent la majeure partie du carbone, de l’azote, de l’énergie libre et de la réduction des équivalents nécessaires à la croissance et à la division cellulaire. De ce point de vue, il devient clair que la conversion de tout le glucose en CO2 par phosphorylation oxydative dans les mitochondries pour maximiser la production d’ATP va à l’encontre des besoins d’une cellule proliférante. Une partie du glucose doit être détournée vers des précurseurs macromoléculaires tels que l’acétyl-CoA pour les acides gras, les intermédiaires glycolytiques pour les acides aminés non essentiels et le ribose pour les nucléotides. Ceci peut expliquer au moins en partie l’avantage sélectif de l’effet Warburg, hypothèse étayée par des mesures récentes de spectroscopie par résonance magnétique nucléaire 13C montrant que les cellules de glioblastome en culture convertissent jusqu’à 90% du glucose et 60% de la glutamine qu’elles acquièrent en lactate ou alanine (16). Bien que la plus grande partie de ce lactate et de l’alanine soit excrétée de la cellule sous forme de déchets, un « sous-produit » de leur génération est une production robuste de NADPH (Fig. 3). En plus de fournir de l’azote pour les acides aminés non essentiels par des réactions de transamination, le catabolisme de la glutamine en lactate produit du NADPH par l’activité de la malate déshydrogénase spécifique du NADP+ (enzyme malique). La signalisation du facteur de croissance régule également l’activité de l’enzyme glycolytique pyruvate kinase et module le flux de carbone au cours des étapes ultérieures de la glycolyse (9, 17). Cette modulation de la pyruvate kinase peut faciliter la réorientation des métabolites du glucose dans le shunt phosphate pentose, ainsi que dans les voies de biosynthèse des nucléotides et des acides aminés. La conversion du glucose et de la glutamine en lactate implique l’enzyme lactate déshydrogénase (LDH). L’inhibition de l’activité de la LDH entrave la prolifération cellulaire (6), peut-être en interférant avec la capacité de la cellule à excréter l’excès de carbone. L’élimination de l’excès de carbone pourrait être nécessaire pour générer suffisamment de NADPH pour soutenir la prolifération cellulaire.
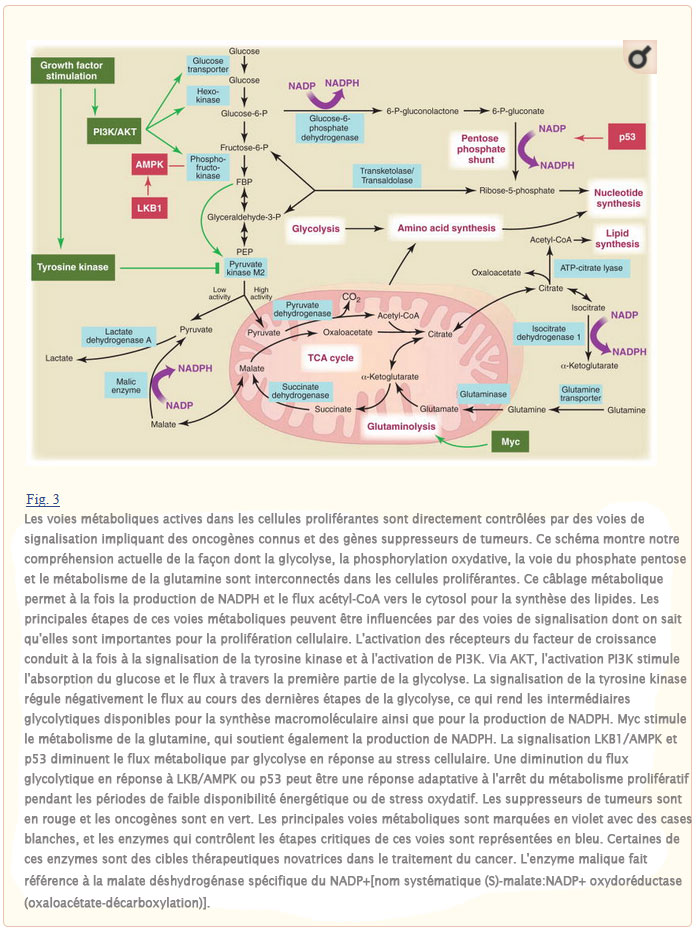
La majeure partie du carbone utilisé pour la synthèse des acides gras provient du glucose. Au cours de ce processus, le glucose est d’abord converti en acétyl-CoA dans la matrice mitochondriale et utilisé pour synthétiser le citrate dans le cycle TCA. Dans des conditions de taux élevés d’ATP/ADP et de NADH/NAD+ présentés par la plupart des cellules proliférantes, ce citrate est excrété dans le cytosol où les lipides sont générés. Dans le cytosol, l’acétyl-CoA est recapturé à partir du citrate et utilisé comme source de carbone pour les chaînes acylées en croissance. La synthèse de l’acétyl-CoA à partir du citrate nécessite l’enzyme ATP citrate lyase (ACL) et la perturbation du LCA entrave la croissance tumorale (18). L’absorption de glutamine semble également essentielle à la synthèse des lipides, car elle fournit du carbone sous forme d’oxaloacétate mitochondrial pour maintenir la production de citrate au cours de la première étape du cycle du TCA (16). Ainsi, le métabolisme de la glutamine et du glucose est orchestré pour soutenir la production d’acétyl-CoA et de NADPH nécessaires à la synthèse des acides gras. Le flux de métabolites dans d’autres voies synthétiques pour la synthèse des acides nucléiques et des acides aminés doit être équilibré de la même manière.
La production excessive de lactate qui accompagne l’effet Warburg semble être une utilisation inefficace des ressources cellulaires. Chaque lactate excrété de la cellule gaspille trois carbones qui pourraient autrement être utilisés pour la production d’ATP ou la biosynthèse de précurseurs macromoléculaires. Il est possible que le déversement de l’excès de carbone sous forme de lactate soit efficace parce qu’il permet une incorporation plus rapide du carbone dans la biomasse, ce qui, à son tour, facilite la division cellulaire rapide. Pour la plupart des cellules proliférantes, les nutriments ne sont pas limitatifs, de sorte qu’il n’y a pas de pression sélective pour optimiser le métabolisme en vue d’obtenir un rendement en ATP. En revanche, il existe une pression sélective pour le taux de métabolisme. Les réponses immunitaires et la réparation des plaies dépendent de la vitesse d’expansion proliférative des cellules effectrices. Pour survivre, l’organisme doit signaler aux cellules répondantes de maximiser leur taux de croissance anabolique. Les cellules qui convertissent le plus efficacement le glucose et la glutamine en biomasse proliféreront le plus rapidement. Pour l’organisme, les nutriments peuvent être rares et il existe des voies actives dans les tissus spécialisés et non proliférants pour recycler l’excès de lactate et d’alanine déversé pendant la croissance cellulaire rapide des cellules proliférantes. Le cycle de Cori dans le foie peut recycler le lactate généré par les tissus en prolifération active en glucose, et des voies analogues existent pour recycler l’alanine générée par le métabolisme « inefficace » de la glutamine (8). Cette capacité à recycler les déchets organiques produits par la prolifération cellulaire lors d’une réponse immunitaire ou d’une réparation de plaie a un impact minimal sur les réserves d’énergie de l’organisme entier. En outre, il est de plus en plus évident que le métabolisme cellulaire au sein d’une tumeur peut être hétérogène, certaines cellules utilisant l’excès de lactate généré comme combustible pour la phosphorylation oxydative mitochondriale (19).
La régulation métabolique est une composante de l’appareil de croissance cellulaire.
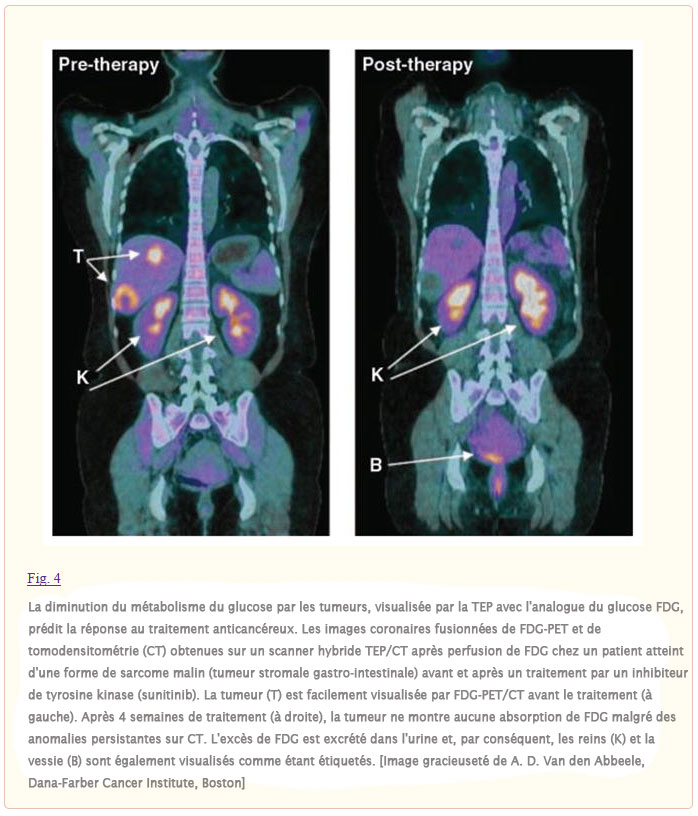
La voie de signalisation de la phosphoinositide 3-kinase (PI3K) est liée à la fois au contrôle de la croissance et au métabolisme du glucose. En plus d’un rôle bien décrit dans l’orientation des acides aminés disponibles vers la synthèse des protéines via mTOR, la voie PI3K régule l’absorption et l’utilisation du glucose (Fig. 3). Même dans les tissus non insulino-dépendants, la signalisation PI3K par l’AKT peut réguler l’expression du transporteur de glucose, améliorer la capture du glucose par l’hexokinase et stimuler l’activité de la phosphofructokinase (2). L’activation de la voie PI3K rend les cellules dépendantes de niveaux élevés de flux de glucose (20). Les petites molécules qui perturbent la signalisation PI3K conduisent à une diminution de l’absorption de glucose par les tumeurs, telle que mesurée par tomographie par émission de positrons 18F-désoxyglucose (FDG-PET), et la capacité d’inhiber l’absorption de FDG par les tumeurs est en corrélation avec la régression tumorale (21). Le retrait du glucose induit la mort cellulaire d’une manière indiscernable de celle observée lors du retrait de la signalisation du facteur de croissance, phénomène qui peut contribuer à la « dépendance oncogène » (22). En effet, lorsqu’elle a été examinée chez des patients cancéreux, la réponse au traitement est prédite par la capacité de perturber le métabolisme du glucose, telle que mesurée par le FDG-PET (23)(Fig. 4).
Il est de plus en plus évident que les enzymes métaboliques peuvent contribuer directement à la cancérogenèse. Des mutations germinales dans les enzymes du cycle TCA succinate dehydrogénase et fumarate hydratase ont été identifiées dans certaines formes de cancer rénal humain, de paragangliome et de phéochromocytome (24, 25). L’un des effets de ces mutations est l’activation de l’utilisation du glucose à médiation Hif1α (26). Une analyse récente du glioblastome humain multiforme, un cancer agressif du cerveau, a révélé que jusqu’à 12 % des tumeurs portent la même mutation ponctuelle dans le gène codant pour l’isocitrate cytosolique déshydrogénase-1 (IDH1) (27). La mutation monoallélique du même résidu dans IDH1, ou le résidu analogue dans l’enzyme apparentée IDH2, est une caractéristique commune des gliomes, puisque plus de 80 % des gliomes indolents portent une telle mutation (28, 29). IDH1 et IDH2 couplent l’interconversion de l’isocitrate cytosolique et α-ketoglutarate dans une réaction NADP+/NADPH-dépendante. L’effet de cette mutation sur le métabolisme cellulaire n’est pas clair ; cependant, étant donné le besoin important de NADPH dans la synthèse macromoléculaire et le contrôle redox, les altérations dans la production de NADPH peuvent affecter la prolifération cellulaire ou les taux de mutation (30). Alternativement, de telles mutations peuvent favoriser la production de citrate à partir de α-ketoglutarate comme précurseur de carbone pour la synthèse macromoléculaire.
De nombreux oncogènes sont des tyrosine kinases. Une caractéristique commune de la signalisation de la tyrosine kinase associée à la prolifération cellulaire est la régulation du métabolisme du glucose. Contrairement aux cellules différenciées, les cellules proliférantes expriment sélectivement l’isoforme M2 de l’enzyme glycolytique pyruvate kinase (PK-M2) (9). Contrairement aux autres isoformes pyruvate kinase, la PK-M2 est régulée par des protéines tyrosine-phosphorylées (17). La phosphotyrosine signalant en aval d’une variété de signaux de croissance cellulaire partage la capacité commune de réguler négativement l’activité de la PK-M2 (17). En réponse à la liaison phosphotyrosine-protéine, la PK-M2 est induite dans un état de faible activité. Cette régulation de l’activité enzymatique peut constituer un commutateur moléculaire qui permet aux cellules de métaboliser le glucose par glycolyse d’une manière compatible avec la prolifération du métabolisme cellulaire uniquement lorsque des signaux de croissance sont présents (Fig. 3). Bien que contre-intuitive, c’est la forme de faible activité de la PK-M2 qui est nécessaire à la prolifération cellulaire. Ce règlement permet à la PK-M2 d’agir comme un garde-barrière qui dicte le flux de carbone dans les voies de biosynthèse par opposition au catabolisme complet pour la production d’ATP. À l’appui de cette idée, le PK-M2 est nécessaire pour la prolifération in vivo (9).
Les cellules tumorales humaines dont la croissance est stimulée par l’oncogène MYC sont particulièrement sensibles au retrait de la glutamine (31), et les gènes impliqués dans le métabolisme de la glutamine semblent être sous le contrôle transcriptionnel direct et indirect de la protéine MYC (32, 33). La déplétion de glutamine des cellules transformées par le MYC entraîne la perte rapide des intermédiaires du cycle du TCA et la mort cellulaire (31). De plus, cette dépendance à la glutamine pour la survie n’est pas liée à la production d’ATP par le métabolisme de la glutamine.
Les voies de suppression des tumeurs peuvent également réguler le métabolisme cellulaire et peuvent agir pour coordonner l’utilisation des nutriments avec la physiologie cellulaire. Par exemple, l’expression p53 contrôle les gènes métaboliques et modifie l’utilisation du glucose. L’expression de TIGAR, un gène induit par p53, entraîne l’inhibition de la phosphofructokinase, la réorientation du glucose vers le shunt phosphate pentose et la production de NADPH (34). Il peut s’agir d’une réponse adaptative qui protège la cellule du stress oxydatif, car le NADPH est nécessaire pour générer la forme réduite de glutathion, qui est une défense intracellulaire majeure contre les dommages causés par les espèces réactives de l’oxygène (ROS).
La phosphorylation oxydative mitochondriale est la principale source cellulaire de production de ROS. On prévoit que les cellules ayant une absorption excessive de nutriments qui n’ont pas été converties en glycolyse aérobie auront une phosphorylation oxydative et une production accrue de ROS. Cet état métabolique inadapté peut être à la base de la sélection évolutive pour l’induction de l’apoptose et/ou de la sénescence dans le cadre d’une augmentation des ROS. Comme certains oncogènes entraînent l’absorption du glucose, cette hypothèse peut expliquer la sénescence induite par l’oncogène. Par exemple, le Ras oncogène provoque des altérations du métabolisme du glucose (35) mais provoque une sénescence lorsqu’il est exprimé dans des cellules sans oncogène coopérant (36). Cette hypothèse est étayée par l’observation que la levure en phase stationnaire perd sa viabilité lorsqu’elle est exposée à des niveaux élevés de glucose et à aucun nutriment supplémentaire (37). Des études sur les levures ont également démontré que la phosphorylation oxydative s’arrête pendant la phase S pour limiter les dommages causés par l’ADN à médiation ROS, ce qui souligne l’importance de limiter la phosphorylation oxydative et la production de ROS dans les cellules proliférantes (38).
Qu’est-ce qui déclenche le passage de la phosphorylation oxydative à la glycolyse aérobie ?
Une explication proposée pour l’observation de Warburg est que l’hypoxie tumorale sélectionne les cellules dépendantes du métabolisme anaérobie (39). Cependant, les cellules cancéreuses semblent utiliser le métabolisme glycolytique avant l’exposition à des conditions hypoxiques. Par exemple, les cellules leucémiques sont hautement glycolytiques (40, 41), mais ces cellules résident dans la circulation sanguine à des tensions d’oxygène plus élevées que les cellules de la plupart des tissus normaux. De même, les tumeurs pulmonaires survenant dans les voies respiratoires présentent une glycolyse aérobie, même si ces cellules tumorales sont exposées à l’oxygène pendant la tumorigenèse (9, 42). Ainsi, bien que l’hypoxie tumorale soit clairement importante pour d’autres aspects de la biologie du cancer, les données disponibles suggèrent qu’il s’agit d’un événement tardif qui peut ne pas être un facteur majeur dans le passage à la glycolyse aérobie par les cellules cancéreuses.
La vision classique du métabolisme est celle d’un système homéostatique autocorrecteur où un noyau d’enzymes d’entretien ménager permet à la cellule de répondre aux demandes bioénergétiques changeantes. Cependant, comme nous l’avons décrit ci-dessus, l’évolution des données probantes indique plutôt un système à régulation dynamique qui est programmé pour répondre aux exigences de la prolifération cellulaire ou aux besoins spécifiques de chaque tissu différencié, selon le cas. Pour les tissus proliférants normaux, comme dans l’embryon en développement ou pendant une réponse immunitaire chez l’adulte, les signaux provenant des facteurs de croissance permettent aux cellules d’utiliser les nutriments pour la croissance (41, 43). L’une des fonctions des voies oncogènes est peut-être de stimuler l’assimilation autonome des nutriments par les cellules et de programmer le métabolisme prolifératif, alors que l’une des fonctions des voies de suppression des tumeurs est d’empêcher l’utilisation des nutriments pour les processus anabolisants. Dans ce modèle, pour que le cancer se développe, des mutations sont nécessaires pour donner aux cellules la capacité d’acquérir des nutriments et de réguler de façon coordonnée les voies métaboliques afin de soutenir la prolifération. Cette altération du contrôle métabolique peut résulter du retour à un programme embryonnaire ou de l’évolution de la capacité de modifier le métabolisme cellulaire existant d’une manière qui favorise la croissance cellulaire.
Métabolisme cellulaire et cancer humain
En principe, les dépendances métaboliques des cellules cancéreuses peuvent être exploitées pour le traitement du cancer. Par exemple, une grande partie du cancer humain dépend d’une signalisation aberrante par la voie PI3K/Akt, et les agents qui ciblent PI3K et diverses molécules de signalisation en aval font actuellement l’objet d’essais cliniques. Les preuves de plus en plus nombreuses que l’activation de PI3K entraîne une dépendance accrue à la glycolyse suggèrent que ces agents peuvent exercer une partie de leur effet en perturbant le métabolisme du glucose. Les médicaments ciblant les principaux points de contrôle métabolique importants pour la glycolyse aérobie, comme la PK-M2 ou la LDH-A, pourraient également être étudiés en tant que thérapies anticancéreuses potentielles. De plus, les médicaments développés pour cibler les maladies métaboliques comme le diabète de type 2 peuvent être utilisés dans le traitement du cancer. Un certain nombre d’études cliniques rétrospectives ont montré que la metformine, un médicament largement utilisé contre le diabète, peut offrir un bénéfice possible dans la prévention du cancer ainsi que des résultats améliorés lorsqu’il est utilisé avec d’autres thérapies contre le cancer (44). La metformine et la phénformine, un composé apparenté plus puissant, activent l’AMPK dans les cellules, ce qui suggère que la phénformine ou d’autres activateurs de l’AMPK pourraient également être utilisés comme adjuvant au traitement du cancer. L’utilisation optimale de ces médicaments nécessitera une meilleure compréhension du métabolisme des cellules cancéreuses et l’identification des voies de signalisation qui représentent un talon d’Achille pour la prolifération ou la survie des cellules.
Les tissus métaboliques chez les mammifères transforment les aliments ingérés en un apport quasi constant de glucose, de glutamine et de lipides pour équilibrer les besoins métaboliques des tissus différenciés et proliférants. Les modifications de l’équilibre approprié des carburants et/ou des voies de transduction des signaux qui traitent de l’utilisation des nutriments peuvent être à la base de la prédisposition au cancer associée aux maladies métaboliques comme le diabète et l’obésité (45, 46). Une meilleure compréhension de la façon dont le métabolisme de l’ensemble du corps interagit avec le métabolisme tumoral pourrait mieux définir ces risques et identifier les points potentiels d’intervention thérapeutique. De plus, il est possible que la cachexie associée à de nombreux cancers soit exacerbée par la consommation excessive de nutriments par la tumeur, ce qui affecterait la régulation métabolique de l’ensemble du corps. À cette fin, le rôle potentiel des suppléments alimentaires et du contrôle serré du glucose en tant qu’adjuvants au traitement du cancer est un domaine d’investigation actif.
Perspectives d’avenir
Le métabolisme est impliqué directement ou indirectement dans tout ce que fait une cellule. Il y a de plus en plus de preuves de la diaphonie entre les voies de signalisation et le contrôle métabolique dans chaque organisme multicellulaire étudié. Il reste encore beaucoup à apprendre sur la façon dont le métabolisme cellulaire proliférant est régulé. Malgré une longue et riche histoire de recherche, le lien complexe entre le métabolisme et la prolifération demeure un domaine d’investigation passionnant. En effet, de nouvelles voies métaboliques ont été découvertes aussi récemment que dans les années 1980 (47), et il est possible que d’autres voies n’aient pas encore été décrites. La compréhension de cet aspect important de la biologie est susceptible d’avoir un impact majeur sur notre compréhension du contrôle de la prolifération cellulaire et du cancer.
Remerciements
Nous remercions A. Van den Abbeele (Département d’imagerie, Dana-Farber Cancer Institute, Boston) pour l’image FDG-PET. Nous remercions également K. D. Courtney, A. J. Shaywitz et K. D. Swanson pour les discussions réfléchies et la lecture critique du manuscrit et la Damon Runyon Cancer Research Foundation pour son soutien (à M.G.V.V.H.). M.G.V.V.H. reçoit une subvention du National Cancer Institute (NCI) et du NIH ; L.C.C.C. reçoit une subvention du NIH ; et C.B.T. reçoit une subvention du NCI, du NIH et de l’Abramson Family Cancer Research Institute pour étudier les aspects du métabolisme des cellules cancéreuses. M.G.V.H., L.C.C.C. et C.B.T. détiennent des brevets liés au ciblage du métabolisme des cellules cancéreuses et ont des intérêts financiers dans Agios Pharmaceuticals, une société qui cherche à exploiter les altérations du métabolisme du cancer pour de nouveaux traitements.





