Dr Laurent Schwartz (cancérologue- AP-HP)
Prof Marc Henry (Prof Physico- Chimie, Faculté de Strasbourg)
Prof Mireille Summa ( Statisticienne- Cereremade-Paris-Dauphine) : Frederic Bouillaud (INSERM Institut Cochin Paris)
Dr Catherine Vierling (MBA)
1) Il EXISTE UNE COHORTE INDEMNE DE COVID-19 DANS LE GRAND EST
L’épidémie de coronavirus s’est abattue sur l’Europe, il y a quelques semaines avec son cortège de malades et de morts.
De nombreux cancéreux sont sous bleu de méthylène pour son action anti tumorale.
Nous avons interrogé une base de données de plus de 30 000 personnes pour la plupart sous traitement métabolique (acide lipoique/hydroxycitrate) par le biais des sites internet suivants:
(https://dr-laurentschwartz.com/, https://www.helloasso.com/associations/association-l-espoir-metabolique, https://www.youtube.com/results?search_query=guy+tenenbaum). De cette cohorte informelle nous avons extrait un sous-groupe de 3000 personnes, dont plus de 500 dans le Grand- Est. Il s’agit de patients qui en sus du traitement métabolique ont pris du bleu de Méthylène à la dose de 75 mg trois fois par jour. Ces patients ont été contactés par internet (vidéo et e- mail). Nous avons eu une seule réponse quant à une possible contamination par le Covid-19 (un syndrome grippal modéré). Les limites de ce type d’enquête rétrospective sont évidentes. Mais cela suggère tout de même fortement que le bleu de méthylène puisse protéger contre cette infection-là.
2) LE BLEU DE MÉTHYLÈNE : UN TRAITEMENT SANS DANGER MAJEUR
Le bleu de Méthylène est le premier médicament de synthèse datant de 1878. Le bleu de méthylène a été utilisé successivement et avec succès dans le traitement de la malaria (1), de la lèpre (2) puis plus récemment dans le traitement des maladies neurodégénératives (3). Il est approuvé dans le traitement de la méthémoglobinémie (4) et l’empoisonnement au cyanure (5). C’est un complément largement utilisé dans l’industrie alimentaire.
L’efficacité du bleu de méthylène a été moins étudié dans les maladies virales. Un traitement de l’organe par le bleu diminue le risque de transmission lors de la greffe (6). Le bleu de méthylène a été utilisé seul ou en conjonction avec la photothérapie pour inactiver les virus présents dans le sang (7).Le Bleu de méthylène a été proposé dans le traitement des maladies virales. Un brevet a été posé en ce sens :
https://patents.google.com/patent/US6346529B1/en?q=methylene+blue+virus+treatment&oq=methylene+blue+virus+treatment
Le Bleu de Méthylène a été utilisé avec succès pour le traitement des chocs infectieux (8,9).
La toxicité du bleu de méthylène est faible. Ce médicament inscrit à la liste des médicaments essentiels de l’OMS n’a que peu d’effets secondaires :
- coloration en bleu des urines
- sensation de brûlures urinaires
- des syndromes psychiatriques lors de prise jointe d’inhibiteur de la sérotonine (11,12).
Le bleu de méthylène sous forme injectable fait partie des traitements de base dans les services des urgences.
Dans le dictionnaire Vidal le seul effet secondaire noté pour la forme intra veineuse vendu par la société pharmaceutique marseillaise Provepharm est : Son utilisation en chirurgie de la parathyroïde (non indiquée) a induit des effets indésirables sur le système nerveux central, lorsque l’administration était concomitante à celle de médicaments sérotoninergiques.
3) BLEU DE MÉTHYLÈNE ET COVID-19
Une équipe française vient de publier très récemment une étude très encourageante montrant que l’on pouvait lutter de manière efficace contre le virus SARS-Cov-2 en combinant un médicament anti-paludisme, l’hydroxychloroquine (HCQ), et un antibiotique l’azithromycine (figure 1).
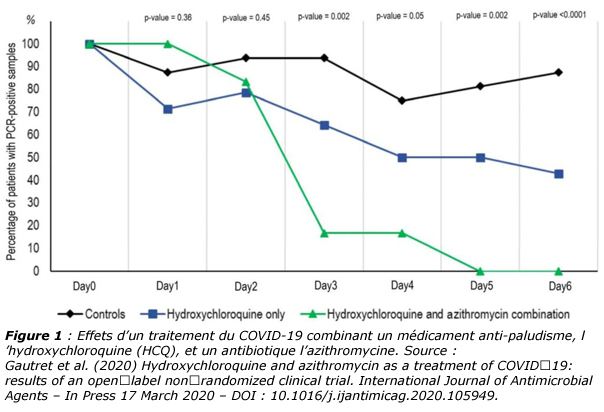 L’antibiotique est juste là pour lutter contre une éventuelle surinfection bactérienne des poumons qui ont été fortement affaiblis par l’attaque virale. Le médicament anti-paludisme HCQ est quant-à-lui le principe actif dont le mécanisme d’action a été étudié [13].
L’antibiotique est juste là pour lutter contre une éventuelle surinfection bactérienne des poumons qui ont été fortement affaiblis par l’attaque virale. Le médicament anti-paludisme HCQ est quant-à-lui le principe actif dont le mécanisme d’action a été étudié [13].
 Il ressort que la chloroquine (CQ) et l’hydroxychloroquine (HCQ) ont la caractéristique chimique d’être des bases faibles (figure 2) qui peuvent élever le pH intracellulaire des organelles acides comme les endosomes ou les lysosomes qui sont indispensables pour que fusion membranaire ait lieu. Comme cette acidification est cruciale pour la maturation et le fonctionnement des endosomes, CQ et HCQ aptes à élever le pH du lysosome de 4,5 à 6,5 à une concentration de 100 µM bloquerait la maturation de l’endosome à une étape intermédiaire de l’endocytose. Ceci aurait pour conséquence l’impossibilité de transporter les virions en milieu intracellulaire. On sait aussi que CQ pourrait également inhiber l’entrée du SARS-CoV dans la cellule en modifiant la glycolysation des récepteurs ACE2 (Angiotensin Converting Enzyme 2) ou des protubérances protéiques. Les récepteurs ACE2 qui s’expriment dans certaines cellules du cœur et des reins sont en fait les points d’entrée dans les cellules humaines de certains coronavirus comme le SARS-CoV-2, ce qui explique la très forte mortalité observée chez les personnes faisant de l’hypertension ou ayant une fragilité cardiaque et/ou rénale. On sait aussi que des fortes concentrations de cytokines sont détectées dans le plasma de malades très gravement atteints. C’est très probablement cette avalanche de cytokines qui aggrave considérablement l’infection virale. Comme l’HCQ est un agent anti-inflammatoire efficace qui a été abondamment utilisé dans le traitement des maladies auto-immunes, cette molécule est donc capable de faire décroître de manière significative la production de cytokines et des facteurs pro-inflammatoires. Le problème de la chloroquine est que, de part son effet sur les récepteurs ACE2, elle peut entraîner des problèmes cardiaques et rénaux. D’où la nécessité de pouvoir disposer d’un autre traitement moins toxique et surtout très peu onéreux pour tous ceux qui ne supporteraient pas les effets secondaires de la chloroquine.
Il ressort que la chloroquine (CQ) et l’hydroxychloroquine (HCQ) ont la caractéristique chimique d’être des bases faibles (figure 2) qui peuvent élever le pH intracellulaire des organelles acides comme les endosomes ou les lysosomes qui sont indispensables pour que fusion membranaire ait lieu. Comme cette acidification est cruciale pour la maturation et le fonctionnement des endosomes, CQ et HCQ aptes à élever le pH du lysosome de 4,5 à 6,5 à une concentration de 100 µM bloquerait la maturation de l’endosome à une étape intermédiaire de l’endocytose. Ceci aurait pour conséquence l’impossibilité de transporter les virions en milieu intracellulaire. On sait aussi que CQ pourrait également inhiber l’entrée du SARS-CoV dans la cellule en modifiant la glycolysation des récepteurs ACE2 (Angiotensin Converting Enzyme 2) ou des protubérances protéiques. Les récepteurs ACE2 qui s’expriment dans certaines cellules du cœur et des reins sont en fait les points d’entrée dans les cellules humaines de certains coronavirus comme le SARS-CoV-2, ce qui explique la très forte mortalité observée chez les personnes faisant de l’hypertension ou ayant une fragilité cardiaque et/ou rénale. On sait aussi que des fortes concentrations de cytokines sont détectées dans le plasma de malades très gravement atteints. C’est très probablement cette avalanche de cytokines qui aggrave considérablement l’infection virale. Comme l’HCQ est un agent anti-inflammatoire efficace qui a été abondamment utilisé dans le traitement des maladies auto-immunes, cette molécule est donc capable de faire décroître de manière significative la production de cytokines et des facteurs pro-inflammatoires. Le problème de la chloroquine est que, de part son effet sur les récepteurs ACE2, elle peut entraîner des problèmes cardiaques et rénaux. D’où la nécessité de pouvoir disposer d’un autre traitement moins toxique et surtout très peu onéreux pour tous ceux qui ne supporteraient pas les effets secondaires de la chloroquine.
4) Biochimie du bleu de méthylène (MB⊕)
Le bleu de méthylène (figure 3) est une molécule synthétisée pour la première fois en 1876 par le chimiste allemand Heinrich Caro, par oxydation du diméthyl-4-phenylène-diamine par le chlorure ferrique en présence d’H2S. Sa structure chimique sera établie en 1884. En 1887, le pathologiste polonais Czeslaw Checinski, appliqua une combinaison de bleu de méthylène et d’éosine sur des frottis sanguins et découvrit ainsi l’existence des parasites Plasmodium malariae en forme de pâquerette et Plasmodium falciparum en forme de faucille [14].
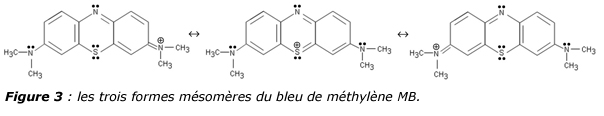 Suite à cette découverte, le médecin Paul Ehrlich (1854-1915) développa un mélange de bleu de méthylène et de fuschsine pour distinguer entre les différents types de globules blancs. Il constata alors que certains colorants pouvaient être des médicaments redoutablement efficaces aptes à tuer de manière spécifique certains organismes tout en laissant d’autres tissus intacts. C’est ainsi que le bleu de méthylène fut surnommé dès 1891, « le boulet magique » dans la lutte contre la malaria, en remplacement de la quinine, substance naturelle dont la production était très limitée. Puis ce fut le tour de la quinacrine en 1931, suivie de la chloroquine en 1934 afin d’éviter la coloration bleue de la peau et du blanc de l’œil. Il existe donc une filiation chimique et biologique évidente en le bleu de méthylène et la chloroquine ou l’hydroxychloroquine. Le tableau 1, montre d’ailleurs un classement par ordre d’efficacité de différents médicaments anti-malaria [15]. On voit que le bleu de méthylène y figure en très bonne place.
Suite à cette découverte, le médecin Paul Ehrlich (1854-1915) développa un mélange de bleu de méthylène et de fuschsine pour distinguer entre les différents types de globules blancs. Il constata alors que certains colorants pouvaient être des médicaments redoutablement efficaces aptes à tuer de manière spécifique certains organismes tout en laissant d’autres tissus intacts. C’est ainsi que le bleu de méthylène fut surnommé dès 1891, « le boulet magique » dans la lutte contre la malaria, en remplacement de la quinine, substance naturelle dont la production était très limitée. Puis ce fut le tour de la quinacrine en 1931, suivie de la chloroquine en 1934 afin d’éviter la coloration bleue de la peau et du blanc de l’œil. Il existe donc une filiation chimique et biologique évidente en le bleu de méthylène et la chloroquine ou l’hydroxychloroquine. Le tableau 1, montre d’ailleurs un classement par ordre d’efficacité de différents médicaments anti-malaria [15]. On voit que le bleu de méthylène y figure en très bonne place.
https://patents.google.com/patent/US6346529B1/en?q=methylene+blue+virus+treatment&oq=methylene+blue+virus+treatment. On notera aussi qu’une publication récente démontre que les parasites responsables de la malaria peuvent aussi transmettre des virus à ARN [16], ce qui vient renforcer l’idée que les médicaments anti-paludisme puissent être d’un précieux secours dans la lutte contre les coronavirus qui font partie de la famille des virus à ARN. Le fait, que le bleu de méthylène purifié soit plus actif que la chloroquine dans la lutte contre la malaria, et ce avec beaucoup moins d’effets secondaires, démontre a priori tout l’intérêt de tester cette molécule très peu onéreuse dans la lutte contre le COVID-19. Mais, l’intérêt pour le bleu de méthylène se trouve aussi renforcé pour bien d’autres raisons.
i) Cette molécule est connue depuis 1876 et a donc été étudiée sous toutes les coutures au niveau de ses propriétés acido-basiques ou oxydo-réductrices. La figure 4 montre ainsi toutes les espèces chimiques susceptibles d’exister en solution aqueuse. Donc, lorsqu’on administre du bleu de méthylène, ce n’est pas une molécule que l’on administre mais tout un ensemble de molécules, ce qui explique l’extrême polyvalence de ce médicament, actif dans beaucoup de pathologies allant de la microbiologie à la psychiatrie. Ainsi, le bleu de méthylène est actif dans la thérapie de la méthémoglobinémie, du choc septique, de l’encéphalopathie et de l’ischémie. Comme indiqué plus haut, le bleu de méthylène peut être considéré comme un précurseur des agents anti-malaria comme la quinacrine et la chloroquine, des antihistaminiques de type phénothiazine inhibiteur des récepteurs H1 sous forme de prométhazine. C’est aussi la première drogue antipsychotique sous la forme de chlorpromazine (lobotomie chimique) et il pourrait s’avérer être un médicament majeur dans la lutte contre le cancer. Concernant plus particulièrement les infections virales, on notera que bleu de méthylène lorsqu’il capte un électron forme un radical MB relativement stable puisque susceptible d’être délocalisé sur plusieurs formes mésomères. Surtout ce radical possède un pKa voisin de 9, ce qui le rend sur le plan acido-basique très proche de la chloroquine. On devrait donc avoir la même inhibition de la fusion membranaire par alcalinisation des endosomes qu’avec la chloroquine.
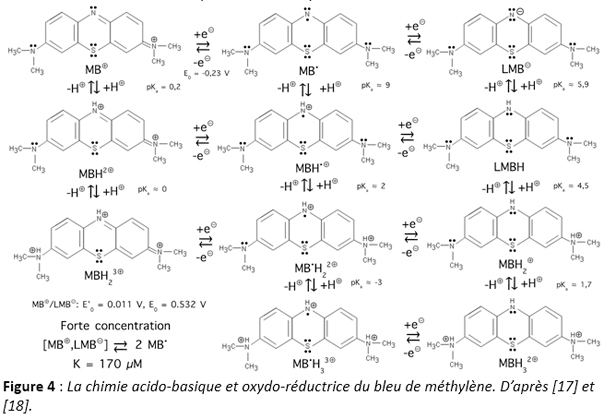 ii) Pour de faibles concentrations in vivo, le bleu de méthylène et sa forme leuco réduite et incolore sont en équilibre. Par conséquent, le bleu de méthylène, en plus d’être l’ancêtre de la chloroquine, forme un couple d’oxydo-réduction réversible qui peut servir de donneur d’électrons artificiel à la chaine de transport des électrons présente dans les mitochondries [19]. On rappelle ici que plusieurs protéines enchâssées dans la membrane interne des mitochondries sont aptes à transférer des électrons et pomper des protons contre un gradient de concentration dans l’espace intermembranaire (pour générer un gradient de protons nécessaire à la synthèse d’ATP).
ii) Pour de faibles concentrations in vivo, le bleu de méthylène et sa forme leuco réduite et incolore sont en équilibre. Par conséquent, le bleu de méthylène, en plus d’être l’ancêtre de la chloroquine, forme un couple d’oxydo-réduction réversible qui peut servir de donneur d’électrons artificiel à la chaine de transport des électrons présente dans les mitochondries [19]. On rappelle ici que plusieurs protéines enchâssées dans la membrane interne des mitochondries sont aptes à transférer des électrons et pomper des protons contre un gradient de concentration dans l’espace intermembranaire (pour générer un gradient de protons nécessaire à la synthèse d’ATP).
 Ces complexes peuvent recevoir des électrons depuis des espèces réduites comme NADH ou FADH2 pour les amener au dioxygène afin de le réduire, via des transporteurs CoQ (complexes I, II et III) ou cytochromes-c (complexes III et IV). Le bleu de méthylène peut donner ses électrons soit à CoQ, soit à Cyt-c, ce qui permet d’augmenter la l’activité du complexe IV (figure 5). Le bleu de méthylène a aussi une action hormétique puisqu’à faible dose il peut interagir directement avec le dioxygène et réduire la quantité de radicaux superoxyde produits de manière secondaire par la phosphorylation oxydative et protéger ainsi la mitochondrie de l’oxydation. Pour des doses plus élevées, il peut capter les électrons de la chaîne respiratoire et ainsi réduire l’activité de ces complexes. Des études in vitro ont montré que l’activité maximale du complexe IV était atteinte pour une dose de 0,5 µM de bleu de méthylène, tandis qu’au-delà de 5 µM, l’activité du complexe IV commence à être inhibée et ce d’autant plus que la concentration augmente. Des études in vivo sur des rats ont montré une activité locomotrice maximale à une dose de 4 mg/kg tandis qu’aucun effet n’est observé en dessous de 1 mg/kg ou au-dessus de 10 mg/kg. Enfin au-delà d’une dose de 50 mg/kg on observe une diminution de l’activité locomotrice au lieu d’une activation.
Ces complexes peuvent recevoir des électrons depuis des espèces réduites comme NADH ou FADH2 pour les amener au dioxygène afin de le réduire, via des transporteurs CoQ (complexes I, II et III) ou cytochromes-c (complexes III et IV). Le bleu de méthylène peut donner ses électrons soit à CoQ, soit à Cyt-c, ce qui permet d’augmenter la l’activité du complexe IV (figure 5). Le bleu de méthylène a aussi une action hormétique puisqu’à faible dose il peut interagir directement avec le dioxygène et réduire la quantité de radicaux superoxyde produits de manière secondaire par la phosphorylation oxydative et protéger ainsi la mitochondrie de l’oxydation. Pour des doses plus élevées, il peut capter les électrons de la chaîne respiratoire et ainsi réduire l’activité de ces complexes. Des études in vitro ont montré que l’activité maximale du complexe IV était atteinte pour une dose de 0,5 µM de bleu de méthylène, tandis qu’au-delà de 5 µM, l’activité du complexe IV commence à être inhibée et ce d’autant plus que la concentration augmente. Des études in vivo sur des rats ont montré une activité locomotrice maximale à une dose de 4 mg/kg tandis qu’aucun effet n’est observé en dessous de 1 mg/kg ou au-dessus de 10 mg/kg. Enfin au-delà d’une dose de 50 mg/kg on observe une diminution de l’activité locomotrice au lieu d’une activation.
iii) En plus d’être utile dans tous les cas d’insuffisance respiratoire, en forçant la réduction du dioxygène en eau dans les mitochondries, le bleu de méthylène est aussi un agent facilitant l’oxydation du NADPH avec formation d’eau oxygénée (figure 6).

Par cette génération d’eau oxygénée, le bleu de méthylène est aussi un agent modulateur du système immunitaire, ce qui peut s’avérer très utile en cas d’emballement de ce dernier comme on le voit avec les avalanches de cytokines chez les cas graves de COV-19.
iv) On sait enfin que le bleu de méthylène, pour des raisons qui restent encore à élucider, aide à lutter contre le vieillissement cellulaire et les maladies neurodégénératives. Or, on a pu constater que les enfants qui ont un organisme et un système nerveux en plein développement semblent être des porteurs sains. On pourrait donc penser que les personnes deviennent sensibles au SARS-CoV-2 dès que leur croissance corporelle ou neuronale ralentit de manière conséquente, ce qui expliquerait que les enfants soient naturellement « immunisés ». Ici aussi, le bleu de méthylène a probablement un rôle à jouer.
Pour toutes ces raisons, il semble impératif que la piste du bleu de méthylène soit sérieusement étudiée dans la lutte contre l’épidémie de COVID-19, surtout afin d’éviter aux personnes gravement atteintes, le passage par le respirateur artificiel, dont le nombre est forcément très restreint sur le territoire en raison du coût et de la très haute technicité de l’appareillage et les conséquences de fibrose pulmonaire séquellaire à moyen terme. Le bleu de méthylène, lui ne coûte quasiment rien, n’est pas toxique à faible dose et possède comme seul inconvénient de colorer en vert ou en bleu les urines des malades.
5) ESSAI CLINIQUE OUVERT PROSPECTIF
Essai monocentrique testant l’apport du bleu de méthylène à la dose de 75 mg matin midi et soir chez des patients atteints de Covid-19
Critères d’inclusion
- Patients atteints de Covid-19 : diagnostic clinique (céphalées, fièvre, arthralgie, dyspnée…) si possible prouvé par PCR
- Plus de 18 ans
Critères d’exclusion
- Karnovsky inférieur à 70
- Prise de médicaments anti sérotoninergique
LES DESCRIPTEURS A RENSEIGNER PAR PATIENT SUIVI POUR LE COVID-19
Voici une liste de descripteurs que nous suggérons pour le suivi d’un patient qui est en contact avec l’hôpital,
- soit parce qu’il y est hospitalisé,
- soit parce qu’il est à domicile mais est passé par les urgences et fait l’objet d’une surveillance médicale.
- soit qu’il est suivi par un médecin de ville
Il s’agit de mesures pour la plupart faciles à faire qui donnent des informations indirectes sur la charge virale du malade. Ces mesures n’incluent pas celle de la charge virale qui serait certes pertinente mais il n’y pas à ce jour suffisamment de tests disponibles et l’on a donc proposé des variables de substitution pour suivre l’évolution de la virulence de la maladie.
Variables signalétiques
- sexe
- âge
- tabagisme (nombre de cigarettes par jour)
- consommation d’alcool
- prise de thiazolidinediones (antidiabétiques)
- prise d’ibuprofène
- prise d’ inhibiteurs de ACE
- antécédents maladies du parenchyme pulmonaire et d’infarctus
Variables à mesurer tous les jours
- un indicateur auto renseigné par le patient quant à l’évolution de son état aux différentes dates,
- la température au matin et soir
- la Tension Artérielle
- Dyspnée à quantifier si possible
- pH urinaire matin et soir
- État général selon échelle de Karnovsky
Références
- Coulibaly, B., Zoungrana, A., Mockenhaupt, F. P., Schirmer, R. H., Klose, C., Mansmann, U., Müller, O. (2009). Strong gametocytocidal effect of methylene blue-based combination therapy against falciparum malaria: a randomised controlled trial. PloS one, 4(5).
- DE ALMEIDA, A. O. (1938). Treatment of leprosy by oxygen under high pressure associated with methylene blue.
- Yang, S. H., Li, W., Sumien, N., Forster, M., Simpkins, J. W., & Liu, R. (2017). Alternative mitochondrial electron transfer for the treatment of neurodegenerative diseases and cancers: Methylene blue connects the dots. Progress in neurobiology, 157, 273-291.
- Brent, J., Burkhart, K., Dargan, P., Hatten, B., Megarbane, B., Palmer, R., & White, J. (Eds.). (2017). Critical care toxicology: diagnosis and management of the critically poisoned patient.
- Hanzlik, P. J. (4 February 1933). « Methylene Blue As Antidote for Cyanide Poisoning ». 100 (5): 357.
- Helfritz, F. A., Bojkova, D., Wanders, V., Kuklinski, N., Westhaus, S., von Horn, C., Swoboda, S. (2018). Methylene blue treatment of grafts during cold ischemia time reduces the risk of hepatitis c virus transmission. The Journal of infectious diseases, 218(11), 1711-1721.
- Friedman, L. I., Stromberg, R. R. (1993). Viral inactivation and reduction in cellular blood products. Revue française de transfusion et d’hémobiologie, 36(1), 83-91.
- Preiser, J. C., Lejeune, P., Roman, A., Carlier, E., De Backer, D., Leeman, M., … & Vincent, J. L. (1995). Methylene blue administration in septic shock: a clinical trial. Critical care medicine, 23(2), 259-264
- Kanter, M., Sahin, S. H., Basaran, U. N., Ayvaz, S., Aksu, B., Erboga, M., & Colak, A. (2015). The effect of methylene blue treatment on aspiration pneumonia. journal of surgical research, 193(2), 909-919.
- Kwok, E. S., & Howes, D. (2006). Use of methylene blue in sepsis: a systematic review. Journal of intensive care medicine, 21(6), 359-363.
- Ramsay, R. R., Dunford, C., & Gillman, P. K. (2007). Methylene blue and serotonin toxicity: inhibition of monoamine oxidase A (MAO A) confirms a theoretical prediction. British journal of pharmacology, 152(6), 946-951.
- Gillman, P. K. (2006). Methylene blue implicated in potentially fatal serotonin toxicity. Anaesthesia, 61(10), 1013-1014.
- Liu et al., « Hydroxychloroquine, a less toxic derivative of chloroquine, is effective in inhibiting SRAS-CoV-2 infection in vitro », Cell Discovery (2020), 6 : 16. DOI : https://doi.org/10.1038/s41421-020-0156-0.
- Krafts, E. Hempelmann, A. Skorska-Stania, « From methylene blue to chloroquine : a breif review of the development of an antimalarial therapy ». Parasitol. Res. (2012) 111 : 1-6.
- [3] B. Fall et al., « Plasmodium falciparum susceptibility to standard and potential anti-malarial drugs in Dakar, Senegal, during the 2013-2014 malaria season », Malaria Journal (2015) 14 (60), 10.1186/s12936-015- 0589-3 . hal-01220028.
- Charon., « Novel RNA viruses associated with Plasmodium vivax in human malaria and Leucocytozoon parasites in avian disease », PLoS Pathog. (2019), 15(12) :e1008216, https://doi.org/10.1371/journal.ppat.1008216
- Impert, A. Katafias, P. Kita, A. Mills, A. Pietkiewicz-Graczyk, G. Wrzeszcz, « Kinetics and mechanism of a fast leuco-Methylene Blue oxidation by copper(II)–halide species in acidic aqueous media », Dalton Trans. (2003) 348-353.
- Contineanu, C. Bercu, I. Contineanu, A. Neacsu, « A chemical and photochemical study of radical species formes in methylene blue acidic and basic aqueous solutions, Analele Universităţii din Bucureşti – Chimie (serie nouă), (2009), vol 18 no. 2, 29 – 37.
- K. Bruchey and F. Gonzalez-Lima, « Behavioral, Physiological and Biochemical Hormetic Responses to the Autoxidizable Dye Methylene Blue », Am J Pharmacol Toxicol. 2008 January 1; 3(1): 72–79.





